 Twój kurs chemii organicznej obejmuje wiele różnych rodzajów izomerów.
Twój kurs chemii organicznej obejmuje wiele różnych rodzajów izomerów.
izomery mają ten sam wzór cząsteczkowy, ale coś w nich jest innego.
izomery geometryczne, rodzaj stereoizomeru, różnią się geometrią lub kształtem. Dzieje się tak, gdy podstawniki są zablokowane w określonym stosunku do siebie.,
mówię zablokowany, ponieważ, w przeciwieństwie do izomerów konformacyjnych w projekcjach Newmana, nie można po prostu obracać cząsteczki, aby zmienić zależność między podstawnikami.
w tym poradniku przyjrzymy się izomerom geometrycznym alkenów, w tym cis trans i E Z.
Izomeryzm Cis/Trans
izomeryzm Cis/Trans jest zwykle postrzegany z podstawnikami po obu stronach podwójnego wiązania alkenowego.
Jak to się dzieje?
między hybrydyzowanymi atomami węgla sp2 występują wiązania podwójne alkenu. Przypomnijmy: hybrydy sp2 mają geometrię trygonalną-płaską lub „płaską”.
(nie podoba ci się to?, Recenzja hybrydyzacja sp2.)
ale to nie hybryda, na którą patrzymy.
zamiast tego, to nie-hybrydyczny orbital p, który tworzy drugie wiązanie między 2 atomami węgla.
SP3 hybrydyzowane pojedyncze lub simga bond można swobodnie obracać.
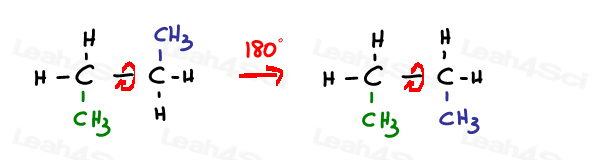
SP2 wiązania pi są zablokowane na miejscu.
jedynym sposobem obrócenia tego wiązania jest zerwanie wiązania podwójnego, obrócenie i reformowanie wiązania podwójnego –co zwykle nie jest obserwowane.
w rzeczywistości wymaga to wysokiej energii, co zobaczysz w reakcjach Dielsa później.,
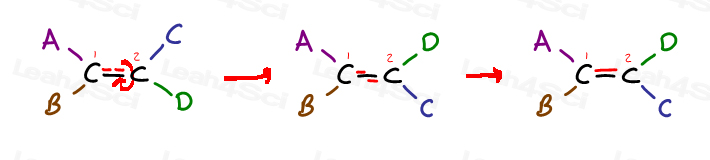
spójrz na następujący ogólny Alken i jest to 4 podstawniki:
węgiel 1 ma podstawniki A i B; węgiel 2 ma podstawniki C i D.
ale zwróć uwagę, że A jest po tej samej stronie co C, A B jest po tej samej stronie co D.
jedynym sposobem, aby przynieść obok D jest zerwanie wiązania pi, obrócenie cząsteczki i reforma wiązania pi. W przeciwnym razie A jest zablokowane w pobliżu C, A B jest zablokowane w pobliżu D.,
Cis vs Trans Alkenes
spójrzmy na 2 wersje 2-butenu: 2-buten jest łańcuchem 4-węglowym z podwójnym wiązaniem między węglami 2 i 3.
możemy więc narysować to niepoprawnie, jako liniową cząsteczkę:
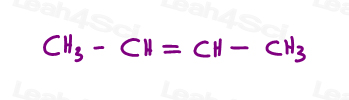
lub narysować każdy węgiel sp2 pod kątem wiązania 120 stopni. Daje mi to możliwość umieszczenia obu grup metylowych w górę, w dół lub jednej w górę i jednej w dół.
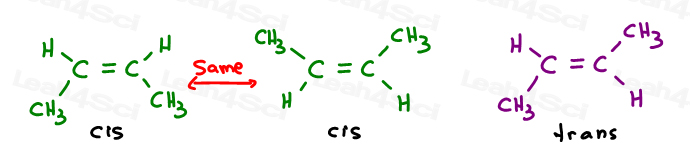
dwa pierwsze są właściwie takie same: oba cis., Widzisz, mogę odwrócić cząsteczkę i sprawić, że pierwsza nałoży się na drugą, nie zrywając żadnych wiązań.
trzeci jest unikalny. Jedynym sposobem nałożenia trzeciego jest zerwanie podwójnego wiązania.
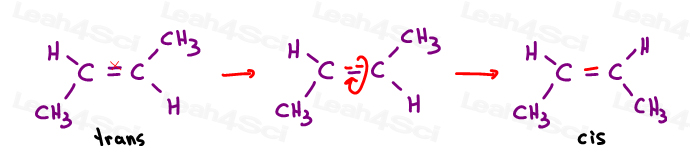
CIS Alkenes
lubię myśleć o cis jako o 'siostrach'. Są razem po tej samej stronie.
alkeny Cis mają podstawniki po tej samej stronie wiązania podwójnego.
Trans Alkenes
lubię myśleć o Trans substitutorach jako o przeniesieniu się od siebie.’Umieszczając je po przeciwnych stronach.,
Trans alkenes mają swoje podstawniki po przeciwnych stronach.
nazewnictwo CIS/Trans Alkenes:
Po zidentyfikowaniu cis / trans alkenes, nazywanie ich jest dość proste.
1) Po pierwsze, wymień Alken za pomocą poniższego tutoriala.
2) następnie po prostu dodaj 'cis' lub 'trans' przed nazwą.,
weź 2 izomery geometryczne 2-butenu:
ich właściwe nazwy są następujące:
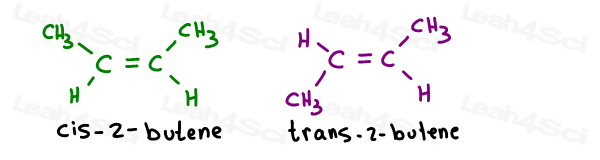
gdy istnieje tylko jedno wiązanie pi, nie musisz określać, który węgiel jest cis albo trans od tego czasu. To zrozumiałe.
gdy na cząsteczce znajduje się więcej niż jedno wiązanie podwójne, należy określić, które jest cis, a które trans.,
Weź tę cząsteczkę na przykład: 2,5-oktadien

ta cząsteczka ma 2 wiązania pi. Jeden cis i jeden trans.
ponieważ istnieje więcej niż jedna więź pi, musisz określić, która więź pi jest cis, a która jest trans.
stabilność alkenu
nie wszystkie izomery mają taką samą stabilność.
chodzi o stabilność – w chemii organicznej lub ogólnie w nauce.

Trans alkenes są bardziej stabilne niż ich odpowiedniki cis.,
jest to bardziej widoczne przy większych podstawnikach.
Trans Alkenes
w trans alkenach podstawniki są skierowane od siebie.
nie „wpadają sobie w twarz” i dlatego nie zwracają uwagi na inne grupy.
Alkenes Cis
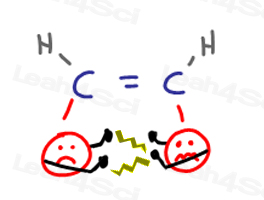 podstawniki CIS alkenów są blisko siebie i będą się wzajemnie widzieć.”Powoduje to „argumenty”, gdy jedna grupa atakuje przestrzeń osobistą drugiej.
podstawniki CIS alkenów są blisko siebie i będą się wzajemnie widzieć.”Powoduje to „argumenty”, gdy jedna grupa atakuje przestrzeń osobistą drugiej.
gdy grupy próbują się od siebie oddalić, powodują obciążenie cząsteczki.,
wszystko to prowadzi do niezadowolenia i wyższej energii CIS konformacji.
Cis& Trans na związki Cykliczne
struktury pierścieniowe lub związki cykliczne mogą również wykazywać izomeryzm cis / trans bez obecności wiązania pi.
pamiętaj, że podstawnikami będą cis i trans, jeśli zostaną zablokowane. Obligacje Pi są jednym ze sposobów na ich zablokowanie. Pierścienie to inna sprawa.
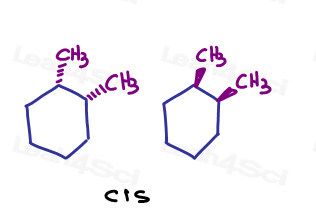
na przykład w 1,2-dimetylocykloheksanie mogę pokazać oba podstawniki przechodzące do strony lub oba wychodzące ze strony.,
ponieważ są skierowane w tym samym kierunku, są cis do siebie.
Jeśli pokażę jeden wchodzący na stronę, a drugi wychodzący ze strony. Są dla siebie trans.
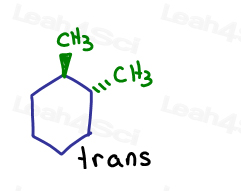
mimo że węgle są sp3 i sigma związane ze sobą, sama cząsteczka nie może się obracać ze względu na strukturę pierścienia. Zamknięte.
jedynym sposobem, aby przekształcić cis-1,2-dimetylocykloheksan w trans-1,2-dimetylocykloheksan, jest złamanie pierścienia, obrócenie i reforma pierścienia.,
a co jeśli na węglu sp2 jest więcej niż jeden podstawnik?
do tej pory przyjrzeliśmy się cząsteczkom z jednym podstawnikiem po obu stronach węgla SP2 związanego pi.
Co się stanie, jeśli na węglu sp2 mamy Wiązanie pi z 2 różnymi atomami lub grupami?
spójrz na 3-metylo-2-penten:
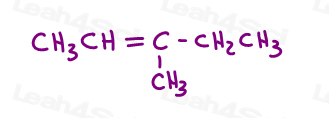
tutaj w strukturze linii:
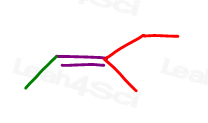
możesz narysować tę cząsteczkę na dwa różne sposoby. Ale czy przy wyborze cis lub trans porównasz czerwony metyl lub czerwony etyl z Zielonym metylem?,
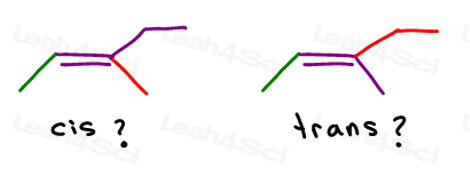
podczas gdy niektórzy profesorowie nauczą Cię porównywać większe grupy, odpowiedź jest taka, że nie można porównać po prostu wybrać jedną dla cis i trans.
wprowadzenie notacji E Z
gdy Wiązanie pi ma więcej niż jeden podstawnik po każdej stronie lub zawiera podstawniki bez węgla, będziemy potrzebować bardziej zaawansowanego systemu identyfikacji izomeryzmu geometrycznego.
System E Z wymaga uporządkowania grup po obu stronach obligacji pi., Musimy określić, czy grupy o wyższym priorytecie znajdują się obok siebie, Z (myśl cis), czy od siebie, E (myśl trans).
ale najpierw musimy nauczyć się rangi grup za pomocą notacji Cahn-Ingold-Prelog.
poniższy filmik pochodzi z mojej serii chiralność, ale uczy tej koncepcji szczegółowo. Zacznij oglądać od 0:52
Cahn-Ingold-Prelog w podsumowaniu:
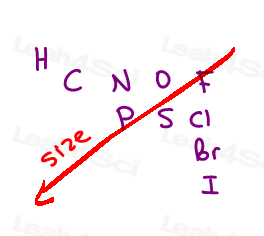
oceniamy Atomy na podstawie ich liczby atomowej.
Nie masa grupy, nie wielkość grupy.
im wyższa liczba atomowa bezpośrednio dołączonego atomu, tym wyższy priorytet.,
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., Użyj ręki lub innego papieru, aby pokryć drugą połowę cząsteczki.
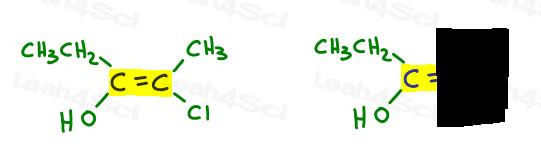
- określ, która grupa ma wyższy priorytet i podaj liczbę 1.
Lubię rysować strzałkę prostopadłą do wiązania pi, aby wyraźnie zobaczyć, czy jest w górę czy w dół przez porównanie.
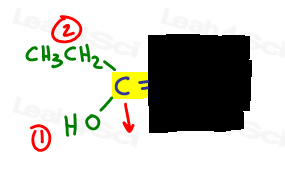
- zrób to samo dla drugiej strony.,
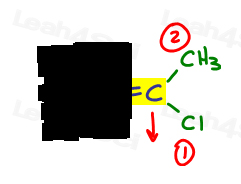
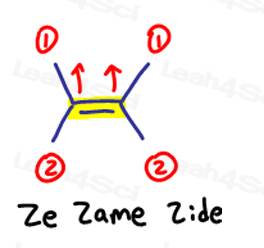
E jest dla Eeposite, Z jest dla Ze Zame Zide
Jeśli dwie grupy o wysokim priorytecie są przeciwne do siebie, pomyśl o nich jako o 'Eeposite' do siebie.
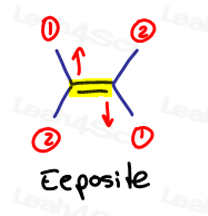 E jest dla Eeposite.
E jest dla Eeposite.
Jeśli dwie grupy o wysokim priorytecie są po tej samej stronie, lub powinienem powiedzieć Na 'ze Zame Zide', są to Z.
dotyczy to cząsteczek, które mają więcej niż 1 węgiel po obu stronach wiązania podwójnego.
Ze Zame Zide.,
wróćmy do powyższego przykładu:
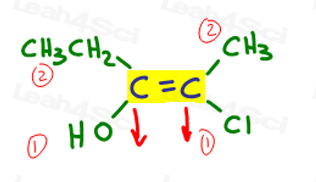
po lewej stronie, OH przewyższa etyl, ponieważ tlen ma wyższą liczbę atomową w porównaniu do węgla. OH jest #1 i punkty w dół.
Po prawej stronie Cl przewyższa metyl, ponieważ chlor ma wyższą liczbę atomową w porównaniu do węgla. Cl jest #1 i punkty w dół.
ponieważ obie strzałki wskazują w tym samym kierunku( w dół), wnioskujemy, że grupy priorytetowe znajdują się na ze Zame Zide, co czyni je Z.,
2 równe grupy priorytetowe
czasami zobaczysz podchwytliwe pytanie, gdzie węgiel sp2 będzie miał 2 Dokładnie takie same grupy.
ponieważ nie można wyróżnić jednego nad drugim, nie będzie izomeryzmu cis/trans ani E/Z.
oto 2 typowe przykłady:
1) a terminal Pi bond
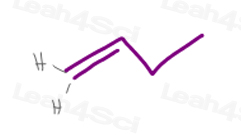
węgiel #1 w 1-buten ma 2 atomy wodoru.
ponieważ H vs H mają dokładnie ten sam priorytet, cząsteczka ta nie będzie miała izomeryzmu cis/trans ani E/Z.,
2) te same dokładne grupy na tym samym SP2 Pi związane węgla.

węgiel #2 w 2-metylo-2-butenie ma 2 grupy CH3.
jeden wydaje się być częścią łańcucha macierzystego, drugi wydaje się być podstawnikiem metylowym.
jednak gdy porównuje się CH3 z CH3, mają one dokładnie taką samą rangę.
ta cząsteczka nie będzie miała izomeryzmu cis/trans n/lub e / Z.,
Cis i Trans vs E i z
jeśli wrócimy do naszych problemów praktyki cis/trans, takich jak cis i trans 2-buten, zobaczysz, że możemy używać systemu E / Z również tutaj.
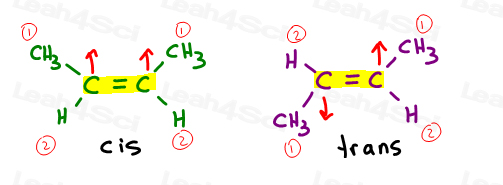
węgiel 2 i 3 mają grupę metylową przewyższającą atom wodoru. Gdy są cis, otrzymujesz Z. gdy są trans, otrzymujesz E.
słowo ostrożności
Możesz używać E/Z dla izomerów cis/trans, ale nie możesz używać cis/trans dla złożonych izomerów E / Z, Jak już pokazaliśmy powyżej.,
Podsumowując
izomery Cis vs trans i E vs z są izomerami geometrycznymi, które występują, gdy podstawniki są zablokowane w pozycji obok lub naprzeciwko siebie. Widać to zarówno w wiązaniach podwójnych dla alkenów, jak i podstawnikach na strukturach pierścieniowych.
Cis alkenes są tej samej wielkości, trans alkenes są po przeciwnych stronach. Gdy podstawniki są bardziej skomplikowane, użyj bardziej zaawansowanej notacji E/Z po określeniu zależności grup o wysokim priorytecie.
Leave a Reply