 o seu curso de Química Orgânica abrangerá muitos tipos diferentes de isómeros.isômeros
o seu curso de Química Orgânica abrangerá muitos tipos diferentes de isómeros.isômeros
têm a mesma fórmula molecular, mas algo sobre eles é diferente.isômeros geométricos, um tipo de estereoisômero, diferem em sua geometria ou forma. Isso acontece quando substituintes são trancados em uma relação específica um com o outro.,
I say locked because, unlike conformational isomers in Newman Projections, you can’t simply rotate the molecule to change the relationship between substituents.
neste tutorial, vamos olhar para alkene geométrica incluindo isómeros cis trans e e Z.
Cis/Trans Isomerism
Cis/Trans isomerism normalmente é visto com substituintes em ambos os lados da alkene ligação dupla. como é que isto acontece?
ligações duplas de alceno ocorrem entre átomos de carbono hibridizados sp2. Recall: os híbridos sp2 têm uma geometria trigonal-planar ou “plana”.
(não se sente confortável com isto?, Rever hibridização sp2.)
mas não é o híbrido que estamos olhando.em vez disso, é o p-orbital não hibridizado que forma uma segunda ligação entre os 2 átomos de carbono.uma ligação única ou simga hibridizada sp3 é livre para rodar.
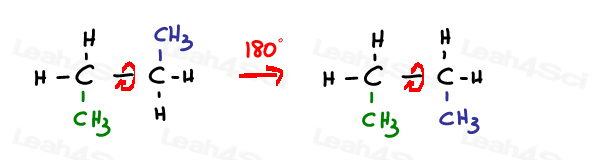
SP2 as ligações pi estão bloqueadas.
a única maneira de rodar esta ligação é quebrar a ligação dupla, rodar e reformar a ligação dupla –o que normalmente não é observado.
na verdade, isso requer alta energia, como você verá em suas reações de Alder Diels mais tarde.,
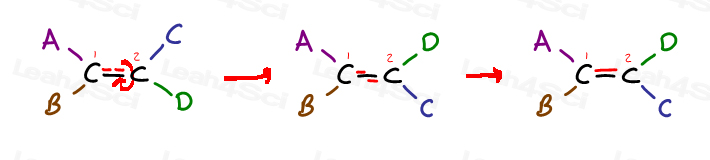
dê uma olhada no seguinte genérico alkene e 4 substituintes:
o Carbono 1 tem substituintes A e B; Carbono 2 tem substituintes C e D.
Mas aviso especificamente como Um está no mesmo lado, como C, e B está do mesmo lado que D.
A única maneira de trazer Um ao lado D é quebrar o pi bond, gire a molécula, e a reforma pi bond. Caso contrário, A é trancado no lugar perto de C, E B é bloqueado no lugar perto de D.,
Cis vs Trans Alcenos
Vamos dar uma olhada em 2 versões do 2-buteno: 2-buteno é um 4-cadeia de carbono com uma ligação dupla entre os carbonos 2 e 3.
assim, podemos desenhar isto incorretamente, como uma molécula linear:
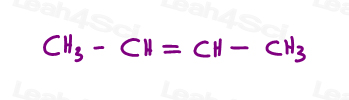
ou, desenhar cada carbono sp2 num ângulo de ligação de 120 graus. Isso me dá a opção de colocar ambos os grupos de metil para cima, para baixo, ou um para cima e um para baixo.
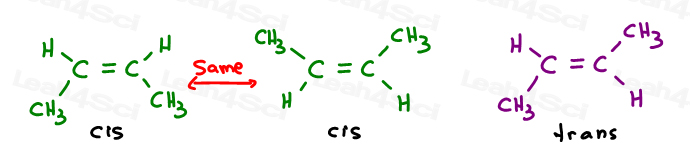
os dois primeiros são na verdade os mesmos: ambos cis., Veja, eu posso virar a molécula e fazer a primeira sobreposição (sobreposição) a segunda sem quebrar nenhuma ligação.o terceiro é único. A única maneira de sobrepor o terceiro é quebrar a dupla ligação.
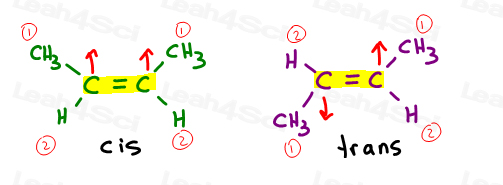
Cis alcenos
i like to think of cis as ‘sisters’. Eles estão juntos do mesmo lado.
os alcenos Cis têm substituintes do mesmo lado da dupla ligação.
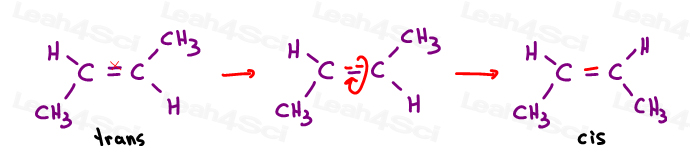
alquenos Trans
i like to think of trans substituents as having ‘ transferred away from each other. Colocando-os em lados opostos.,
Os alquenos Trans têm seus substituintes em lados opostos.
Naming Cis / Trans Alkenes:
Once you have identified cis / trans alkenes, naming them is fairly simple.
1) Primeiro, nomeie o alceno usando o tutorial ligado abaixo.
2) então, simplesmente adicione ‘cis’ ou ‘trans’ na frente do nome.,
Tirar a 2 isômeros geométricos do 2-buteno:
Seus nomes próprios, são as seguintes:
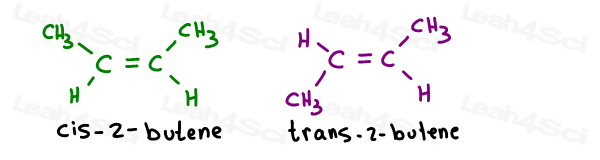
Quando há apenas um pi bond, você não precisa especificar qual o carbono é cis ou trans desde então. É auto-entendido.
Quando você tem mais de uma ligação dupla na molécula, você deve especificar qual é cis e qual é trans.,
Tomar esta molécula por exemplo: 2,5-octadiene

Esta molécula tem 2 pi obrigações. Um IC e um trans.
Uma vez que há mais de uma ligação pi, você tem que especificar qual ligação pi é cis e qual é trans.
estabilidade do alqueno
nem todos os isómeros têm a mesma estabilidade.
é tudo sobre estabilidade-em Química Orgânica ou ciência em geral.

alcenos Trans são mais estáveis do que os seus homólogos da CEI.,
isto é mais aparente com substituintes maiores.
alquenos Trans
num alqueno trans, os substituintes estão virados uns para os outros.eles não “se metem na cara um do outro” e, portanto, não se importam com os outros grupos.
Cis alcenos
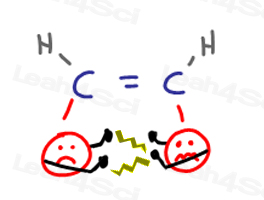 os substituintes de alquenos Cis estão próximos e irão ‘entrar nas faces uns dos outros.’Isso causa’ argumentos ‘ quando um grupo invade o espaço pessoal do outro.quando os grupos tentam afastar-se uns dos outros, causam tensão na molécula.,
os substituintes de alquenos Cis estão próximos e irão ‘entrar nas faces uns dos outros.’Isso causa’ argumentos ‘ quando um grupo invade o espaço pessoal do outro.quando os grupos tentam afastar-se uns dos outros, causam tensão na molécula.,
tudo isso leva a uma insatisfação e maior conformação de energia cis.
Cis& Trans em compostos cíclicos
estruturas anulares ou compostos cíclicos podem também apresentar isomerismo cis / trans sem a presença de uma ligação pi.
lembre-se, os substituintes serão cis e trans se estiverem bloqueados no local. As ligações Pi são uma forma de as trancar no lugar. Os anéis são outro assunto.
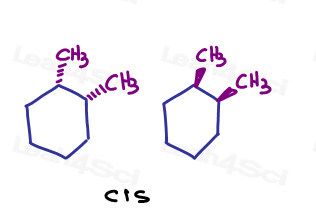
Por exemplo, em 1,2-dimetilciclohexano, posso mostrar ambos os substituintes indo para a página ou ambos saindo da página.,
Uma vez que eles estão apontando na mesma direção, eles são cis uns para os outros.
If I show one going into the page and one going out of the page. Eles são trans um para o outro.
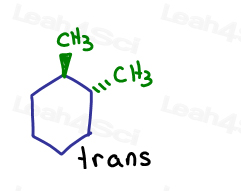
apesar dos carbonos serem sp3 e sigma ligados um ao outro, a molécula em si não pode rodar devido à estrutura do anel. Protegido.
a única maneira de transformar o cis-1,2-dimetilciclo-hexano em trans-1,2-dimetilciclo-hexano é quebrar o anel, rodar e reformar o anel.,e se houver mais de um substituinte no carbono sp2?
até agora, nós temos olhado para moléculas com apenas um substituinte em cada lado do carbono ligado sp2 pi.o que acontece se tivermos uma ligação pi com 2 átomos ou grupos diferentes no carbono sp2?
dê uma olhada no 3-metil-2-penteno:
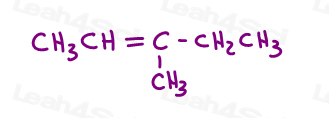
Aqui em estrutura de linha:
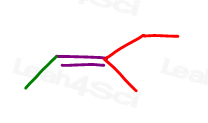
Você pode desenhar esta molécula em 2 maneiras diferentes. Mas você vai comparar o metil vermelho ou etil vermelho com o metil verde quando escolher cis ou trans?,
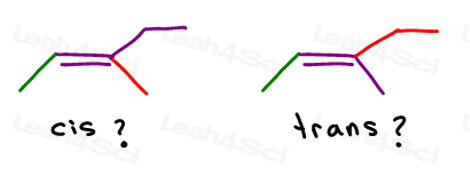
enquanto alguns professores lhe ensinarão a comparar os grupos maiores, a resposta é que você não pode comparar simplesmente escolher um para cis e trans.quando uma ligação pi tem mais do que um substituinte em cada lado, ou contém substituintes Não-carbono, precisaremos de um sistema mais avançado para identificar o isomerismo geométrico.
o sistema E Z requer a Classificação dos grupos em ambos os lados da ligação pi., Nós devemos determinar se os grupos de prioridade mais elevada estão próximos uns dos outros, Z (pensar cis), ou longe uns dos outros, E (pensar trans).
mas primeiro, temos que aprender a classificar grupos usando a notação Cahn-Ingold-Prelog.
o vídeo abaixo é de minha série chirality, mas ensina este conceito em detalhes. Comece a observar a partir de 0: 52
Cahn-Ingold-Prelog em resumo:
estamos a classificar átomos com base no seu número atómico.
Não massa do grupo, não tamanho do grupo.
Quanto maior for o número atómico do átomo directamente ligado, maior será a prioridade.,
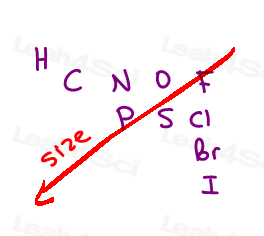
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., Use a mão ou outro papel para cobrir a outra metade da molécula.
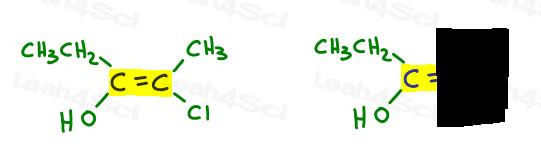
- Determine qual grupo é maior prioridade e coloque um número 1.gosto de desenhar uma seta perpendicular à ligação pi para poder ver claramente se é para cima ou para baixo por comparação.
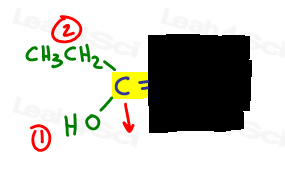
- faça a mesma coisa para o outro lado.,
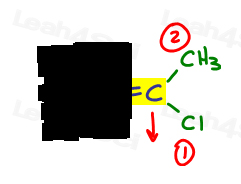
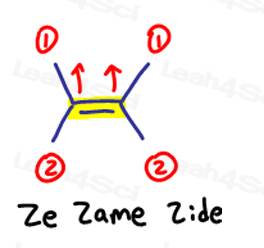
E é para Eeposite, Z é o Zé Zame Zide
Se a dois grandes grupos prioritários estão de frente um para o outro, pense neles como sendo ‘eeposite’ uns com os outros.
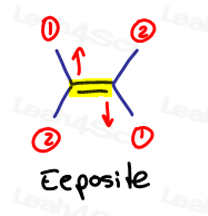 E is for Eeposite.
E is for Eeposite.
Se os dois grupos de alta prioridade estão no mesmo lado, ou devo dizer em “ze Zame Zide”, eles são Z.
isto aplica-se a moléculas que têm mais do que apenas 1 carbono em ambos os lados da dupla ligação.
Ze Zide.,
Vamos voltar para o exemplo acima:
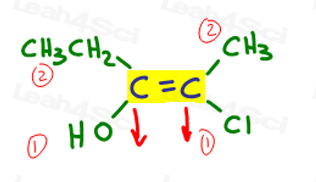
à esquerda, OH supera etílico desde o oxigênio tem maior número atômico, quando comparado ao carbono. Oh é o número 1 e aponta para baixo.
à direita, Cl é superior a metil já que o cloro tem um maior número atômico quando comparado ao carbono. Cl é o número 1 e aponta para baixo.
Uma vez que ambas as setas apontam na mesma direção (para baixo), concluímos que os grupos prioritários estão em ze Zame Zide tornando-o Z.,
2 grupos de prioridade iguais
às vezes você vai ver uma pergunta com rasteira onde um carbono sp2 terá 2 dos mesmos grupos.
Uma vez que não pode classificar um sobre o outro, não haverá isomerismo cis/trans ou E/Z.
Aqui são 2 exemplos comuns:
1) Um terminal pi bond
Carbono #1 em 1-buteno tem 2 átomos de hidrogênio.uma vez que h vs h têm a mesma prioridade exata, esta molécula não terá isomerismo cis / trans ou e / Z.,
2) os mesmos grupos exactos no mesmo carbono ligado a SP2 pi.

Carbono #2 em 2-metil-2-buteno tem 2 CH3 grupos.
um parece ser parte da cadeia mãe, o segundo parece ser um substituinte de metilo.no entanto, quando o CH3 é comparado ao CH3 eles classificam exatamente o mesmo.
esta molécula não terá isomerismo cis/trans N/ou e / Z.,
Cis e Trans vs E E Z
se voltarmos aos nossos problemas de prática cis / trans, tais como cis e trans 2-buteno, você verá que podemos usar o sistema E/Z aqui também.
carbono 2 e 3 cada um tem um grupo metilo superando um átomo de hidrogénio. Quando eles são cis, você tem Z. Quando eles são trans você tem E.
uma palavra de precaução
você pode usar e / Z para isômeros cis / trans, mas você não pode usar cis/trans para isômeros e / Z complexos como já mostramos acima.,
no resumo
Cis vs trans e E vs Z isómeros são isómeros geométricos que ocorrem quando substituintes estão bloqueados na posição ao lado ou opostos um ao outro. Isto é visto em ambas as ligações duplas para alcenos, e substituintes em estruturas de anel.
os alcenos Cis têm o mesmo tamanho, os alcenos trans estão em lados opostos. Quando os substituintes são mais complicados use a notação E/Z mais avançada depois de determinar a relação de grupos de alta prioridade.
Leave a Reply