 uw cursus organische chemie omvat veel verschillende soorten isomeren.
uw cursus organische chemie omvat veel verschillende soorten isomeren.
isomeren hebben dezelfde Molecuulformule, maar iets over hen is anders.
Geometrische isomeren, een type stereoisomeer, verschillen in hun geometrie of vorm. Dit gebeurt wanneer substituenten zijn opgesloten in een specifieke relatie met elkaar.,
Ik zeg vergrendeld omdat, in tegenstelling tot conformationele isomeren in Newman-projecties, je het molecuul niet eenvoudig kunt roteren om de relatie tussen substituenten te veranderen.
in deze tutorial zullen we kijken naar geometrische alkeenisomeren inclusief cis trans en e Z.
Cis/Trans isomerisme
Cis/Trans isomerisme wordt typisch gezien met substituenten aan weerszijden van de alkeen dubbele binding.
hoe gebeurt dit?
alkeen-dubbele bindingen komen voor tussen SP2-gehybridiseerde koolstofatomen. Recall: SP2 hybriden hebben een trigonale-planaire of’ platte ‘ geometrie.
(niet comfortabel met dit?, Beoordeel sp2 hybridisatie.)
maar het is niet de hybride waar we naar kijken.
in plaats daarvan is het de niet-gehybridiseerde p-orbitaal die een tweede binding vormt tussen de 2 koolstofatomen.
een SP3-hybride enkelvoudige of simga-binding is vrij om te roteren.
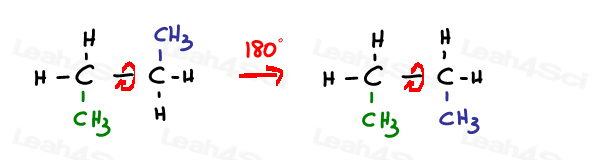
SP2 pi-bindingen zijn vergrendeld.
de enige manier om deze binding te roteren is door de dubbele binding te breken, te roteren en de dubbele binding te hervormen –die meestal niet wordt waargenomen.
in feite vereist dit hoge energie, zoals je later zult zien in je Diels Elzen reacties.,
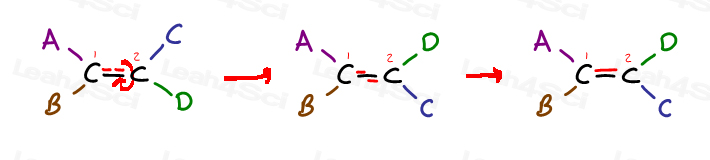
kijk eens naar het volgende generieke alkeen en het zijn 4 substituenten:
koolstof 1 heeft substituenten A en B; koolstof 2 heeft substituenten C en D.
maar merk specifiek op Hoe A aan dezelfde kant staat als C, en B aan dezelfde kant als D.
De enige manier om a naast D te brengen is door de pi-binding te breken, het molecuul te roteren en de pi-binding te hervormen. Anders is A op zijn plaats in de buurt van C, en B is op zijn plaats in de buurt van D.,
Cis vs Trans alkenen
laten we eens kijken naar 2 versies van 2-buteen: 2-buteen is een 4-koolstofketen met een dubbele binding tussen koolstof 2 en 3.
dus, we kunnen dit onjuist tekenen, als een lineair molecuul:
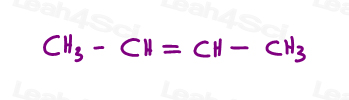
of, tekenen elke SP2 koolstof onder een 120 graden bindingshoek. Dit geeft me de mogelijkheid om beide methylgroepen omhoog, omlaag, of één omhoog en één omlaag te plaatsen.
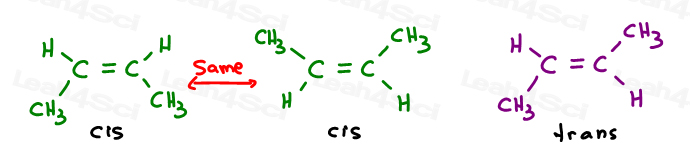
de eerste twee zijn eigenlijk hetzelfde: beide cis., Zie je, Ik kan het molecuul omdraaien en de eerste overlappen de tweede zonder enige bindingen te breken.
de derde is uniek. De enige manier om de derde boven elkaar te leggen is door de dubbele band te verbreken.
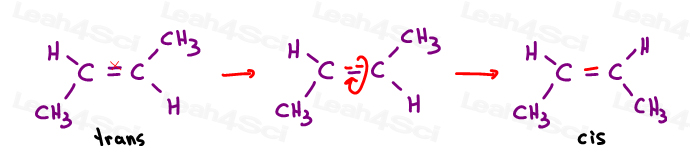
Cis alkenen
Ik zie cis graag als ‘zusters’. Ze staan aan dezelfde kant.Cis-alkenen hebben substituenten aan dezelfde kant van de dubbele binding.
Transalkenen
Ik denk graag dat transubstituenten van elkaar zijn overgedragen. Zet ze aan tegenovergestelde kanten.,Transalkenen hebben hun substituenten aan tegenovergestelde zijden.
het benoemen van Cis / Trans alkenen:
zodra u cis / trans alkenen hebt geïdentificeerd, is het benoemen ervan vrij eenvoudig.
1) noem eerst het alkeen met behulp van de onderstaande tutorial.
2) voeg dan gewoon ‘cis’ of ‘trans’ toe voor de naam.,
neem de 2 geometrische isomeren van 2-buteen:
hun Eigennamen zijn als volgt:
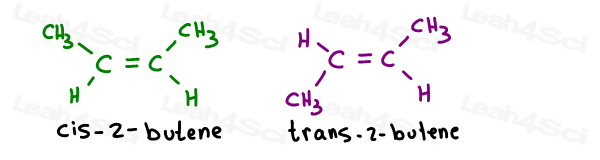
wanneer er slechts één pi-binding is, hoeft u niet te specificeren welke koolstof cis of trans is sindsdien. Het is zelfbegrepen.
wanneer u meer dan één dubbele binding op het molecuul heeft, moet u specificeren welke cis is en welke trans.,
neem dit molecuul bijvoorbeeld: 2,5-octadieen

dit molecuul heeft 2 pi-bindingen. Een cis en een trans.
aangezien er meer dan één pi-binding is, moet u specificeren welke pi-binding cis is en welke trans is.
Alkeenstabiliteit
niet alle isomeren hebben dezelfde stabiliteit.
Het draait allemaal om stabiliteit – in de organische chemie of de wetenschap in het algemeen.

Transalkenenen zijn stabieler dan hun cis-tegenhangers.,
Dit is duidelijker bij grotere substituenten.
Transalkenen
in een transalken staan de substituenten van elkaar af.
ze ‘komen niet in elkaars gezicht’ en let daarom niet op de andere groepen.
Cis-alkenen
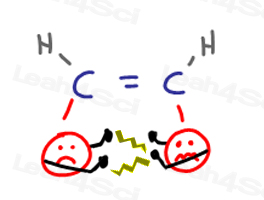 Cis-alkeensubstituenten liggen dicht bij elkaar en komen in elkaars gezicht.’Dit veroorzaakt’ argumenten ‘ wanneer de ene groep de andere persoonlijke ruimte binnendringt.
Cis-alkeensubstituenten liggen dicht bij elkaar en komen in elkaars gezicht.’Dit veroorzaakt’ argumenten ‘ wanneer de ene groep de andere persoonlijke ruimte binnendringt.
wanneer de groepen van elkaar proberen weg te bewegen, veroorzaken ze spanning op het molecuul.,
dit alles leidt tot een ongelukkige en hogere energie CIS-conformatie.
Cis & Trans op cyclische verbindingen
ringstructuren of cyclische verbindingen kunnen ook cis / trans-isomerisme vertonen zonder de aanwezigheid van een pi-binding.
onthoud dat substituenten cis en trans zijn als ze op hun plaats zijn vergrendeld. Pi-obligaties zijn een manier om ze op hun plaats te houden. Ringen zijn een andere zaak.
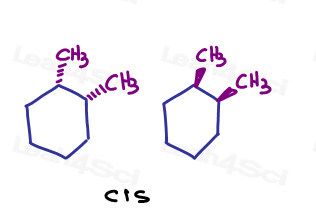
bijvoorbeeld, in 1,2-dimethylcyclohexaan, kan ik beide substituenten tonen die de pagina ingaan of beide die de pagina verlaten.,
omdat ze in dezelfde richting wijzen, zijn ze cis naar elkaar.
als ik één toon die de pagina ingaat en één die de pagina verlaat. Ze zijn trans naar elkaar.
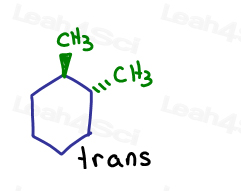
hoewel de koolstoffen sp3 en sigma aan elkaar gebonden zijn, kan het molecuul zelf niet roteren vanwege de ringstructuur. Afgesloten.
de enige manier om cis-1,2-dimethylcyclohexaan om te zetten in trans-1,2-dimethylcyclohexaan is door de ring open te breken, te roteren en te hervormen.,
wat als er meer dan één substituent op de SP2-koolstof zit?
tot nu toe hebben we gekeken naar moleculen met slechts één substituent aan weerszijden van de SP2 pi gebonden koolstof.
Wat gebeurt er als we een pi-binding hebben met 2 verschillende atomen of groepen op de SP2-koolstof?
kijk eens naar 3-methyl-2-penteen:
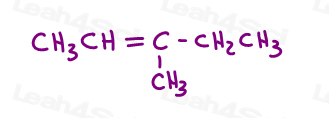
hier in lijnstructuur:
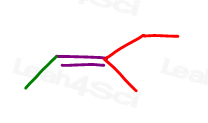
u kunt dit molecuul op 2 verschillende manieren tekenen. Maar vergelijk je de rode methyl of rode ethyl met de groene methyl bij het kiezen van cis of trans?,
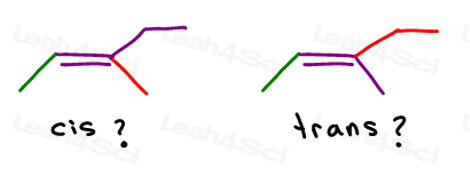
hoewel sommige professoren je zullen leren om de grotere groepen te vergelijken, is het antwoord dat je niet kunt vergelijken door er gewoon een te kiezen voor cis en trans.
introductie van de E Z notatie
wanneer een pi-binding meer dan één substituent aan elke zijde heeft, of niet-koolstofsubstituenten bevat, hebben we een geavanceerder systeem nodig voor het identificeren van geometrisch isomerisme.
Het E Z-systeem vereist een rangschikking van de groepen aan weerszijden van de pi-binding., We moeten bepalen of de hogere prioriteitsgroepen naast elkaar staan, Z (denk cis), of weg van elkaar, E (denk trans).
maar eerst moeten we leren hoe groepen te rangschikken met behulp van de Cahn-Ingold-Prelog notatie.
de video hieronder is uit mijn chirality serie, maar leert dit concept in detail. Begin met kijken vanaf 0: 52
Cahn-Ingold-Prelog in het kort:
we rangschikken atomen op basis van hun atoomnummer.
Geen massa van de groep, Geen grootte van de groep.
hoe hoger het atoomnummer van het direct aangesloten atoom, hoe hoger de prioriteit.,
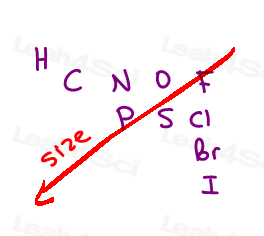
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., Gebruik je hand of een ander papier om de andere helft van het molecuul te bedekken.
- Bepaal welke groep een hogere prioriteit heeft en geef een nummer 1.
ik teken graag een pijl loodrecht op de pi-binding, zodat ik duidelijk kan zien of hij omhoog of omlaag is in vergelijking.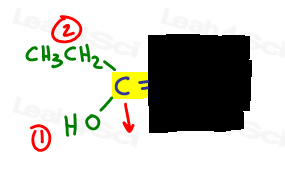
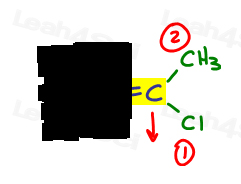
- doe hetzelfde voor de andere kant.,
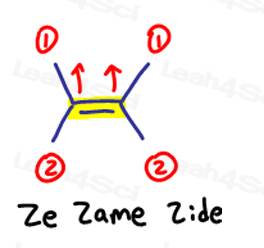
E is voor Eeposite, Z is voor ze Zame zijde
als de twee groepen met hoge prioriteit tegenover elkaar staan, beschouw ze dan als “eeposite” ten opzichte van elkaar.
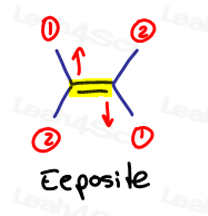 E is voor Eeposite.
E is voor Eeposite.
als de twee groepen met hoge prioriteit aan dezelfde kant staan, of moet ik zeggen op ‘ze Zame Zide,’ zijn ze Z.
Dit geldt voor moleculen die meer dan slechts 1 koolstof aan beide zijden van de dubbele binding hebben.
ze Zame Zide.,
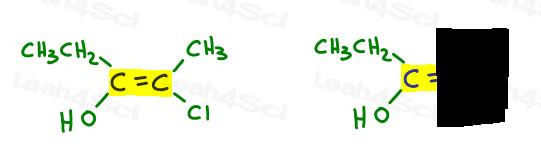
laten we teruggaan naar het voorbeeld hierboven:
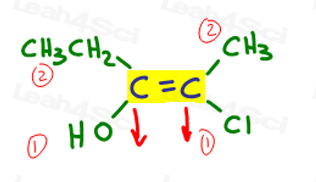
links is o hoger dan ethyl aangezien zuurstof een hoger atoomnummer heeft in vergelijking met koolstof. OH is #1 en punten naar beneden.
rechts is Cl hoger dan methyl omdat chloor een hoger atoomnummer heeft in vergelijking met koolstof. Cl is #1 en wijst naar beneden.
aangezien beide pijlen in dezelfde richting wijzen (naar beneden), concluderen we dat de prioriteitsgroepen op ze Zame Zide staan waardoor het Z.,
2 gelijke Prioriteitsgroepen
soms zie je een strikvraag waarbij een SP2 koolstof 2 van exact dezelfde groepen zal hebben.
omdat u de een niet boven de ander kunt rangschikken, zal er geen cis/trans-of E / Z-isomerisme zijn.
Hier zijn 2 veel voorkomende voorbeelden:
1) een terminale pi-binding
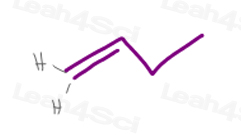
koolstof #1 in 1-buteen heeft 2 waterstofatomen.aangezien H vs H dezelfde exacte prioriteit hebben, zal dit molecuul geen cis/trans of E/Z isomerisme hebben.,
2) dezelfde exacte groepen op dezelfde SP2 pi gebonden koolstof.

koolstof #2 in 2-methyl-2-buteen heeft 2 CH3-groepen.
Eén lijkt deel uit te maken van de ouderketen, de tweede lijkt een methylsubstituent te zijn.
echter, wanneer CH3 wordt vergeleken met CH3, rangschikken ze precies hetzelfde.
dit molecuul zal geen cis/trans n/of E/Z isomerisme hebben.,
Cis en Trans vs E en Z
als we teruggaan naar onze cis/trans oefenproblemen, zoals cis en trans 2-buteen, zul je zien dat we hier ook het E / Z systeem kunnen gebruiken.
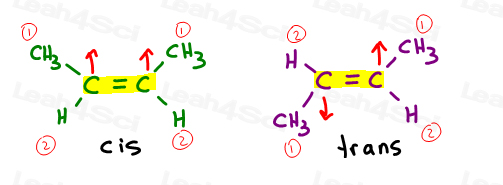
koolstof 2 en 3 hebben elk een methylgroep die een waterstofatoom overtreft. Als ze cis zijn, krijg je Z. als ze trans zijn krijg je E.
een woord van waarschuwing
Je kunt E/Z gebruiken voor cis/trans isomeren, maar je kunt cis/trans niet gebruiken voor complexe E/Z isomeren zoals we hierboven al hebben getoond.,
in samenvatting
Cis vs trans en e vs Z isomeren zijn geometrische isomeren die optreden wanneer substituenten naast of tegenover elkaar worden vergrendeld. Dit wordt gezien in zowel dubbele bindingen voor alkenen, als substituenten op ringstructuren.
Cis-alkenen zijn even groot, trans-alkenen aan tegenovergestelde zijden. Wanneer de substituenten ingewikkelder zijn, gebruik dan de meer geavanceerde E / Z-notatie na het bepalen van de relatie van groepen met hoge prioriteit.
Leave a Reply