 有機化学コースでは、さまざまな種類の異性体をカバーします。
有機化学コースでは、さまざまな種類の異性体をカバーします。
異性体は同じ分子式を持っていますが、それらについての何かが異なります。
立体異性体の一種である幾何異性体は、その形状や形状が異なります。 これは、置換基が互いに特定の関係にロックされている場合に起こります。,
ニューマン投影の立体配座異性体とは異なり、置換基間の関係を変えるために分子を回転させることはできないため、ロックされていると言います。
このチュートリアルでは、我々はcisトランスとE Zを含むアルケン幾何異性体を見ていきます。
Cis/Trans異性性
Cis/Trans異性性は、典型的には、アルケン
これはどのように起こりますか?
アルケン二重結合はsp2ハイブリダイズされた炭素原子の間に発生します。 リコール:sp2ハイブリッドは、三角平面または”平坦”ジオメトリを持っています。
(これに慣れていませんか?, レビュsp2混成.p>
しかし、それは私たちが見ているハイブリッドではありません。
代わりに、2つの炭素原子の間に第二の結合を形成するのは、非ハイブリダイズされたp軌道です。
sp3ハイブリダイズシングルまたはsimgaボンドは自由に回転できます。
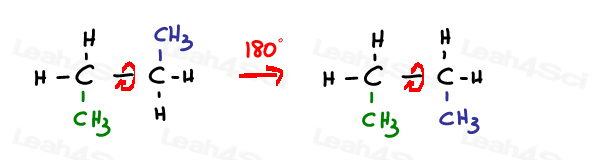
Sp2piボンドは所定の位置にロックされています。
この結合を回転させる唯一の方法は、二重結合を破壊し、回転させ、二重結合を改質することであり、これは典型的には観察されない。
実際には、これは後であなたのDiels Alder反応に見られるように、高いエネルギーを必要とします。,
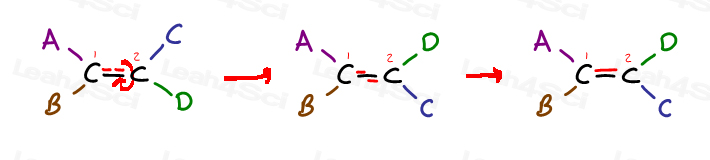
次の一般的なアルケンを見て、それは4つの置換基です:
炭素1は置換基AとBを持ち、炭素2は置換基CとDを持っています
しかし、aがCと同じ側にあり、BがDと同じ側にある方法に特に注意してください
Dの隣にAを持って来る唯一の方法は、pi結合を壊し、分子を回転させ、pi結合を改革することです。 それ以外の場合、AはCの近くにロックされ、BはDの近くにロックされます。,
Cis vs Transアルケン
2-ブテンの2つのバージョンを見てみましょう:2-ブテンは、炭素2と3の間に二重結合を持つ4-炭素鎖です。
だから、我々は線形分子として、これを間違って描くことができます:
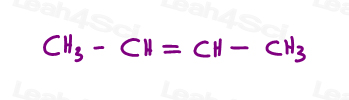
または、各sp2炭素を120度の結合角で描きます。 これは私に両方のメチル基を上、下、または一つの上と一つの下に配置するオプションを与えます。
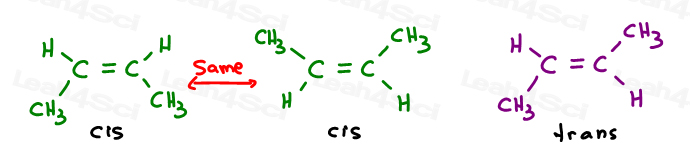
最初の二つは、実際には同じです:両方のcis。, あなたが見る、私は分子を反転させ、結合を壊すことなく、最初の重ね合わせ(重ね合わせ)を第二にすることができます。
第三はユニークです。 三番目を重ね合わせる唯一の方法は二重結合を壊すことです。
Cisアルケン
私はcisを”姉妹”と考えるのが好きです。 彼らは同じ側に一緒にいます。
シスアルケンは二重結合の同じ側に置換基を有する。
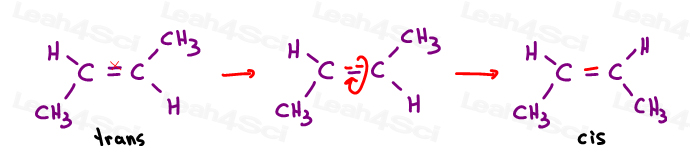
トランスアルケン
私はトランス置換基を互いに離れて移動したものと考えるのが好きです。”それらを反対側に置く。,
トランスアルケンは反対側に置換基を持っている。
Cis/Transアルケンの命名:
cis/transアルケンを特定したら、それらの命名はかなり簡単です。
1)まず、以下にリンクされているチュートリアルを使用してアルケンに名前を付けます。
2)次に、名前の前に’cis’または’trans’を追加するだけです。,
2-ブテンの2つの幾何異性体を取る:
それらの固有名は次のとおりです:
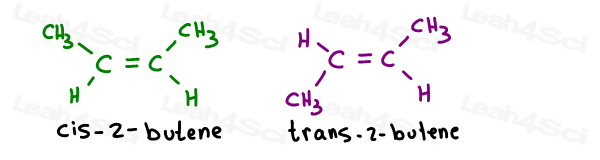
pi結合が一つしかない場合、どの炭素がシスまたはトランスであるかを指定する必要はありません。 それは自己理解です。
分子上に複数の二重結合がある場合は、どちらがcisでどちらがtransであるかを指定する必要があります。,
この分子を例にとる:2,5-オクタジエン

この分子は2つのpi結合を有する。 一つのcisと一つのtrans。
複数のpi結合があるので、どのpi結合がcisでどのpi結合がtransであるかを指定する必要があります。
アルケン安定性
すべての異性体が同じ安定性を有するわけではない。
それはすべての安定性についてです–有機化学または科学一般において。

トランスアルケンは、それらのcis対応よりも安定です。,
これは、より大きな置換基でより明らかである。
トランスアルケン
トランスアルケンでは、置換基は互いに対向している。
彼らは”お互いの顔に入る”ことはないので、他のグループを気にしないでください。
シスアルケン
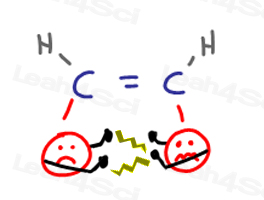 シスアルケン置換基は互いに近くにあり、’お互いに顔になります。”これは、一方のグループが他方の個人的な空間に侵入するときに”議論”を引き起こす。
シスアルケン置換基は互いに近くにあり、’お互いに顔になります。”これは、一方のグループが他方の個人的な空間に侵入するときに”議論”を引き起こす。
グループが互いに離れようとすると、それらは分子にひずみを引き起こす。,
これはすべて不幸で高エネルギーのcis立体配座につながります。
Cis&環状化合物上のTrans
環構造または環状化合物はまた、pi結合の存在なしにcis/trans異性性を示すことができる。 これからもよろしくお願いいたします!!!!!!!!!!! Pi債券は、それらを所定の位置に固定する一つの方法です。 リングは別の問題です。
たとえば、1,2-dimethylcyclohexaneでは、両方の置換基がページに入るか、両方がページから出ることを示すことができます。,
それらは同じ方向を指しているので、それらは互いにcisです。
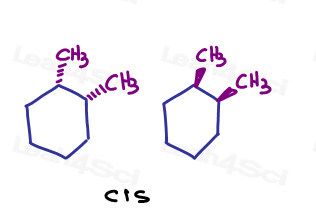
ページに入るものとページから出るものを表示した場合。 彼らはお互いにトランスです。
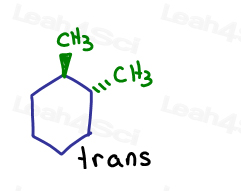
炭素がsp3でシグマ結合していても、分子自体は環構造のために回転することはできません。 ロックされてる
cis-1,2-dimethylcyclohexaneをtrans-1,2-dimethylcyclohexaneに変える唯一の方法は、開いたリングを壊し、回り、そしてリングを改良することです。,
sp2炭素に複数の置換基がある場合はどうなりますか?
今まで、sp2pi結合炭素の両側にただ一つの置換基を持つ分子を見てきました。
2つの異なる原子またはsp2炭素上の基を持つpi結合がある場合はどうなりますか?
3-メチル-2-ペンテンを見てみましょう:
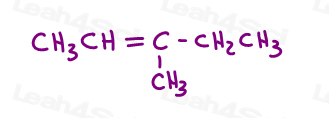
ここでライン構造で:
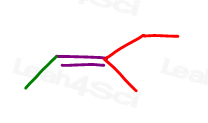
この分子を2つの異なる方法で描くことができます。 しかしシス形かtransを選ぶとき緑のメチルと赤いメチルか赤いエチルを比較しますか。,
一部の教授は、より大きなグループを比較するように教えてくれますが、答えは、cisとtransのいずれかを選択するだけでは比較できないということ
E Z表記の導入
pi結合が両側に複数の置換基を有するか、または非炭素置換基を含む場合、幾何異性を同定するためのより高度なシステム
E Zシステムは、pi結合の両側の基をランク付けする必要があります。, 優先順位の高いグループが隣り合っているかどうか、Z(cisと考える)、または互いに離れているかどうか、E(transと考える)を判断する必要があります。
しかし、まず、Cahn-Ingold-Prelog表記法を使用してグループをランク付けする方法を学ぶ必要があります。
下のビデオは私のchiralityシリーズからのものですが、この概念を詳細に教えています。 0:52から見始める
cahn-Ingold-Prelog要約すると、
原子番号に基づいて原子をランク付けしています。
グループの質量ではなく、グループの大きさではありません。
直接結合した原子の原子番号が高いほど、優先順位は高くなります。,
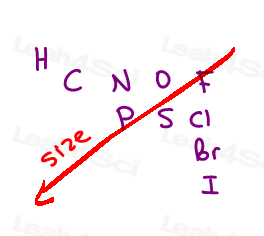
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
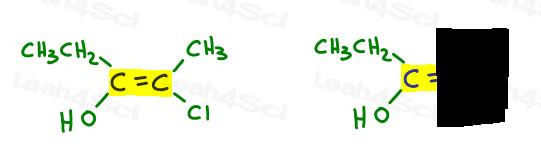
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., 分子の残りの半分をカバーするためにあなたの手や別の紙を使用してください。
- 優先順位の高いグループを決定し、番号1を入れてください。
私はpi結合に垂直な矢印を描くのが好きなので、比較して上下にあるかどうかをはっきりと見ることができます。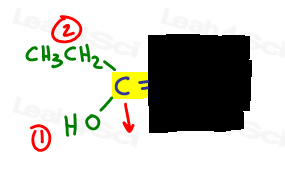
- 反対側についても同じことを行います。,
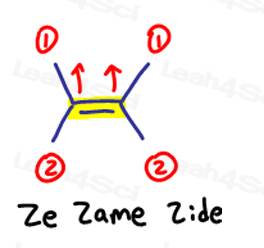
EはEeposite用、ZはZe Zame Zide用です
二つの優先度の高いグループが互いに反対である場合は、それらをお互いに”eeposite”であると考えてください。
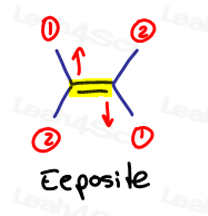 EはEeposite用です。
EはEeposite用です。
二つの優先度の高い基が同じ側にある場合、または”Ze Zame Zide”と言うべきである場合、それらはZです。
これは、二重結合のいずれかの側に1つ以上の炭素を持つ分子に適用されます。
Ze Zame Zide.,
上記の例に戻りましょう:
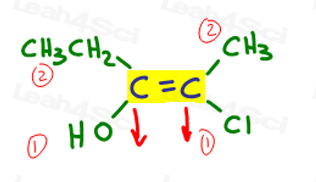
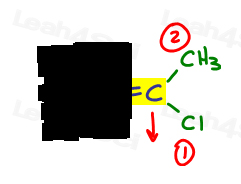
左側では、酸素は炭素に比べて原子番号が高いため、エチルを上回ります。 ああ#1とポイントダウンです。
右側では、塩素は炭素に比べて原子番号が高いため、Clはメチルを上回っています。 Clは#1とポイントダウンです。
両方の矢印が同じ方向(下)を指しているので、優先順位グループはZe Zame Zide上にあり、Zを作成すると結論付けます。,
2等しい優先度グループ
sp2炭素がまったく同じグループの2つを持つトリックの質問が表示されることがあります。
一方を他方よりもランク付けすることはできないので、cis/transまたはE/Z異性体性はありません。
ここでは2つの一般的な例があります:
1)末端pi結合
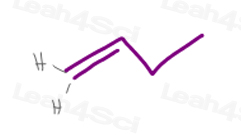
1-ブテン中の炭素#1は2つの水素原子を有する。
H対Hは正確に同じ優先順位を持つので、この分子はcis/transまたはE/Z異性性を持たないでしょう。,
2)同じsp2pi結合炭素上の同じ正確なグループ。

2-メチル-2-ブテン中の炭素#2は2つのCH3基を有する。
一方は親鎖の一部であるように見え、他方はメチル置換基であるように見える。
しかし、CH3とCH3を比較すると、まったく同じランクになります。
この分子はcis/trans n/またはE/Z異性性を有さない。,
CisおよびTrans vs EおよびZ
cisおよびtrans2-ブテンなどのcis/trans実践問題に戻ると、ここでもE/Zシステムを使用できることがわかります。
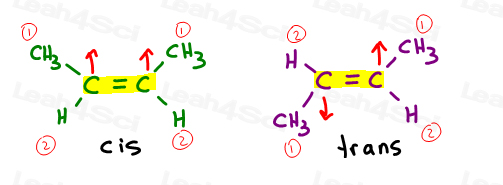
炭素2および3はそれぞれ水素原子を上回るメチル基を有する。 それらがcisであるとき、あなたはZを得ます。transであるとき、あなたはeを得ます。
注意の言葉
cis/trans異性体にはE/zを使うことができますが、上ですでに示したように、複雑なE/Z異性体にはcis/transを使うことはできません。,
要約すると
Cis対transおよびE対Z異性体は、置換基が互いの隣または反対側の位置に固定されているときに生じる幾何異性体である。 これは、アルケンの二重結合と環構造上の置換基の両方に見られる。
Cisアルケンは同じサイズにあり、transアルケンは反対側にあります。 置換基がより複雑である場合、優先度の高い基の関係を決定した後、より高度なE/Z表記法を使用する。
Leave a Reply