 su curso de Química Orgánica cubrirá muchos tipos diferentes de isómeros.
su curso de Química Orgánica cubrirá muchos tipos diferentes de isómeros.
los isómeros tienen la misma fórmula molecular pero algo en ellos es diferente.los isómeros geométricos, un tipo de estereoisómero, difieren en su geometría o forma. Esto sucede cuando los sustituyentes están encerrados en una relación específica entre sí.,
digo bloqueado porque, a diferencia de los isómeros conformacionales en las proyecciones de Newman, no puedes simplemente rotar la molécula para cambiar la relación entre sustituyentes.
en este tutorial, veremos los isómeros geométricos de alqueno, incluidos cis trans y E Z.
isomerismo de Cis/Trans
El isomerismo de Cis/Trans se ve típicamente con sustituyentes a cada lado del doble enlace de alqueno.
¿Cómo sucede esto?
Los dobles enlaces alquenos ocurren entre átomos de carbono hibridados sp2. Recordemos: los híbridos sp2 tienen una geometría trigonal-plana o ‘plana’.
(¿no te sientes cómodo con esto?, Revisión SP2 hibridación.)
Pero no es el híbrido que estamos viendo.
en cambio, es el orbital P no hibridado el que forma un segundo enlace entre los 2 átomos de carbono.
un enlace SP3 hibridado simple o simga es libre de rotar.
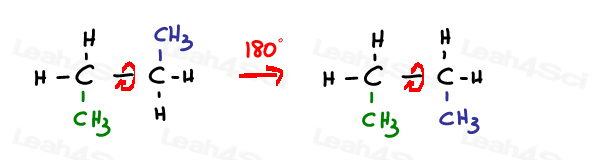
Sp2 enlaces pi están bloqueados en su lugar.
la única manera de rotar este enlace es romper el doble enlace, rotar y reformar el doble enlace, lo que normalmente no se observa.
de hecho, esto requiere alta energía, como verá en sus reacciones de aliso de Diels más adelante.,
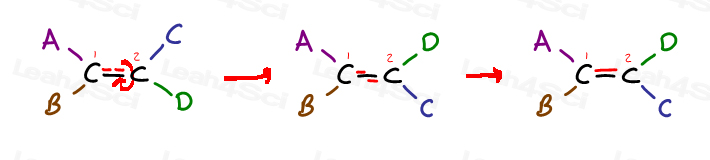
eche un vistazo al siguiente alqueno genérico y tiene 4 sustituyentes:
El carbono 1 tiene sustituyentes A y B; El carbono 2 tiene sustituyentes C y D.
pero observe específicamente cómo A está en el mismo lado que C, y B está en el mismo lado Que D.
la única manera de llevar A A al lado de D es romper el enlace pi, rotar la molécula y reformar el enlace pi. De lo contrario, A está bloqueado en su lugar cerca de C, y B está bloqueado en su lugar cerca de D.,
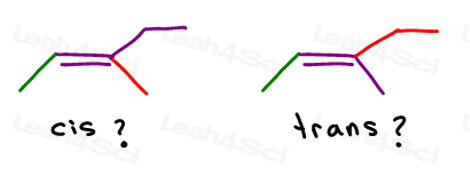
Cis vs Trans Alkenes
echemos un vistazo a 2 versiones de 2-buteno: 2-buteno es una cadena de 4 carbonos con un doble enlace entre los carbonos 2 y 3.
entonces, podemos dibujar esto incorrectamente, como una molécula lineal:
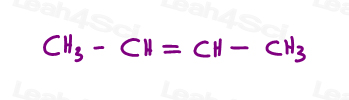
o, dibujar cada carbono sp2 en un ángulo de enlace de 120 grados. Esto me da la opción de colocar ambos grupos metilo arriba, abajo, o uno arriba y uno abajo.
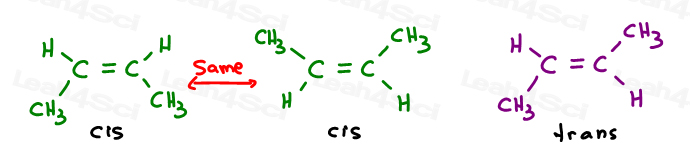
Los dos primeros son en realidad la misma: cis., Verás, puedo voltear la molécula y hacer que la primera se superponga (se superponga) a la segunda sin romper ningún enlace.
el tercero es único. La única manera de superponer el tercero es romper el doble enlace.
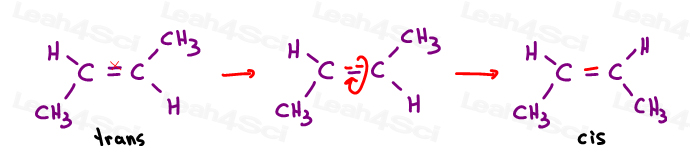
Alquenos Cis
me gusta pensar en cis como ‘hermanas’. Están juntos en el mismo lado.
los alquenos Cis tienen sustituyentes en el mismo lado del doble enlace.
alquenos Trans
me gusta pensar que los sustituyentes trans se han transferido unos de otros. Poniéndolos en lados opuestos.,los trans alquenos tienen sus sustituyentes en lados opuestos.
nombrar alquenos Cis/Trans:
Una vez que haya identificado alquenos cis/trans, nombrarlos es bastante simple.
1) primero, nombra el alqueno usando el tutorial enlazado a continuación.
2) Luego, simplemente añadir ‘cis’ o ‘trans’ delante del nombre.,
Tome la 2 isómeros geométricos de 2-buteno:
Sus nombres propios son como sigue:
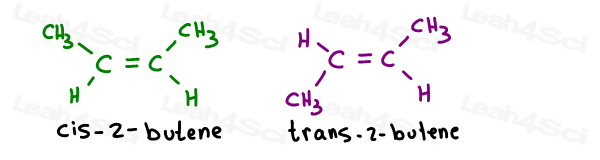
Cuando sólo hay un pi de bonos, usted no tiene que especificar que el carbono es cis o trans desde entonces. Es auto-entendido.
cuando tiene más de un doble enlace en la molécula, debe especificar cuál es cis y cuál es trans.,
Tomar esta molécula por ejemplo: 2,5-octadiene

Esta molécula tiene 2 enlaces pi. Un cis y un trans.
dado que hay más de un enlace pi, debe especificar qué enlace pi es cis y cuál es trans.
estabilidad del alqueno
no todos los isómeros tienen la misma estabilidad.
se trata de la estabilidad, en química orgánica o en la ciencia en general.

Los trans alquenos son más estables que sus contrapartes cis.,
esto es más evidente con sustituyentes más grandes.
Trans alquenos
en un trans alqueno, los sustituyentes se enfrentan entre sí.
No ‘se meten en las caras de los demás’ y por lo tanto, no les importa a los otros grupos.
alquenos de Cis
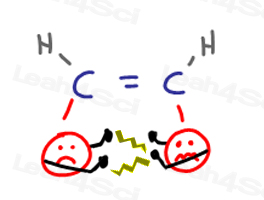 los sustituyentes de alquenos de Cis están muy juntos y se ‘meterán en las caras de los demás.’Esto causa’ discusiones ‘ cuando un grupo invade el espacio personal del otro.
los sustituyentes de alquenos de Cis están muy juntos y se ‘meterán en las caras de los demás.’Esto causa’ discusiones ‘ cuando un grupo invade el espacio personal del otro.
cuando los grupos tratan de alejarse unos de otros, causan tensión en la molécula.,
Todo esto conduce a una conformación CIS de energía infeliz y superior.
Cis& Trans en compuestos cíclicos
Las estructuras de anillo o los compuestos cíclicos también pueden exhibir isomerismo cis / trans sin la presencia de un enlace pi.
recuerde, los sustituyentes serán cis y trans si están bloqueados en su lugar. Los enlaces Pi son una forma de bloquearlos en su lugar. Los anillos son otro asunto.
por ejemplo, en 1,2-dimetilciclohexano, puedo mostrar ambos sustituyentes entrando en la página o ambos saliendo de la página.,
dado que apuntan en la misma dirección, son cis entre sí.
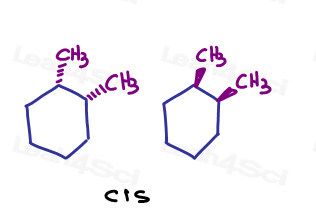
Si me muestran un entrar en la página y en el que va a salir de la página. Son trans el uno al otro.
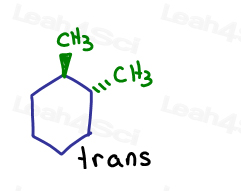
a pesar de que los carbonos son sp3 y sigma unidos entre sí, la molécula en sí no puede girar debido a la estructura del anillo. Bloquear.
la única manera de convertir cis-1,2-dimetilciclohexano en trans-1,2-dimetilciclohexano, es romper el anillo, girar y reformar el anillo.,
¿qué pasa si hay más de un sustituyente en el carbono sp2?
hasta ahora, hemos mirado moléculas con solo un sustituyente a cada lado del carbono unido a sp2 pi.
¿Qué sucede si tenemos un enlace pi con 2 átomos o grupos diferentes en el carbono sp2?
echa un vistazo a las 3-metil-2-penteno:
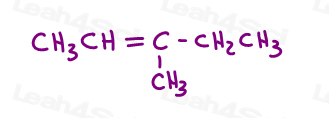
Aquí, en la línea de la estructura:
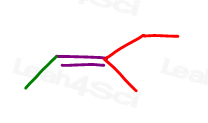
Usted puede dibujar esta molécula en 2 formas diferentes. Pero, ¿comparará el metilo rojo o el etilo rojo con el metilo verde al elegir cis o trans?,
mientras que algunos profesores te enseñarán a comparar los grupos más grandes, la respuesta es que no puedes comparar simplemente elige uno para cis y trans.
introduciendo la notación E Z
Cuando un enlace pi tiene más de un sustituyente en cada lado, o contiene sustituyentes no carbonizados, necesitaremos un sistema más avanzado para identificar el isomerismo geométrico.
el sistema E Z requiere clasificar los grupos a cada lado del enlace pi., Debemos determinar si los grupos de mayor prioridad están uno al lado del otro, Z (piensa cis), o lejos el uno del otro, E (piensa trans).
pero primero, tenemos que aprender a clasificar grupos usando la notación Cahn-Ingold-Prelog.
El video de abajo es de mi serie quirality, pero enseña este concepto en detalle. Comienza a ver desde 0:52
Cahn-Ingold-Prelog en resumen:
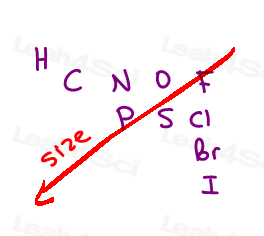
estamos clasificando los átomos en función de su número atómico.
No masa del grupo, no tamaño del grupo.
cuanto mayor sea el número atómico del átomo directamente unido, mayor será la prioridad.,
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., Usa tu mano u otro papel para cubrir la otra mitad de la molécula.
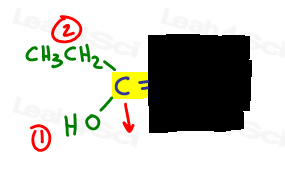
- Determine qué grupo tiene mayor prioridad y ponga un número 1.me gusta dibujar una flecha perpendicular al enlace pi para que pueda ver claramente si está arriba o abajo en comparación.
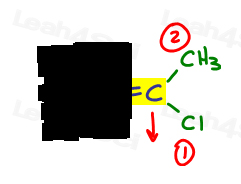
- Hacer lo mismo para el otro lado.,
E es para Eeposite, Z es para Ze Zame Zide
Si los dos grupos de alta prioridad son opuestos entre sí, piense en ellos como ‘eeposite’ entre sí.
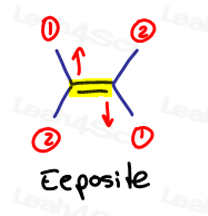 E es para Eeposite.
E es para Eeposite.
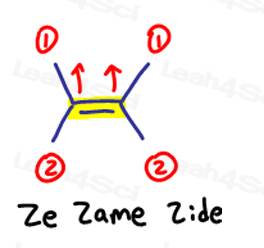
Si los dos grupos de alta prioridad están en el mismo lado, o debería decir en ‘Ze Zame Zide’, son Z.
esto se aplica a las moléculas que tienen más de 1 carbono a cada lado del doble enlace.
Ze Zame Zide.,
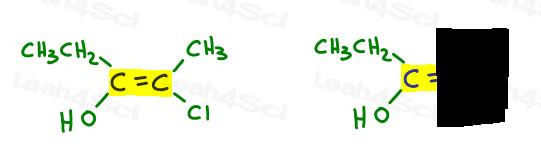
volvamos al ejemplo anterior:
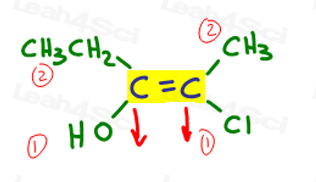
a la izquierda, OH supera al etilo ya que el oxígeno tiene un número atómico más alto en comparación con el carbono. OH es #1 y apunta hacia abajo.
a la derecha, Cl supera al metilo ya que el cloro tiene un número atómico más alto en comparación con el carbono. Cl es #1 y apunta hacia abajo.
dado que ambas flechas apuntan en la misma dirección (hacia abajo), concluimos que los grupos prioritarios están en Ze Zame Zide convirtiéndolo en Z.,
2 grupos de prioridad iguales
a veces verás una pregunta capciosa donde un carbono sp2 tendrá 2 de los mismos grupos exactos.
dado que no puede clasificar uno sobre el otro, NO habrá isomerismo cis/trans o E/Z.
Aquí hay 2 ejemplos comunes:
1) a Terminal Pi bond
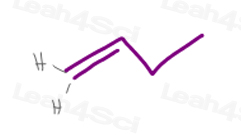
Carbon #1 en 1-el buteno tiene 2 átomos de hidrógeno.dado que H vs H tienen la misma prioridad exacta, esta molécula no tendrá isomerismo cis/trans o E/Z.,
2) los mismos grupos exactos en el mismo carbono ligado a Pi sp2.

Carbono #2 en 2-metil-2-buteno tiene 2 grupos CH3.
parece ser parte de la cadena principal, el segundo parece ser un sustituyente metilo.
Sin embargo, cuando CH3 se compara con CH3 se clasifican exactamente igual.
esta molécula no tendrá isomerismo cis/trans n/o E / Z.,
Cis y Trans vs E Y Z
Si volvemos a nuestros problemas de práctica cis/trans, como cis y trans 2-buteno, verás que también podemos usar el sistema E / Z aquí.
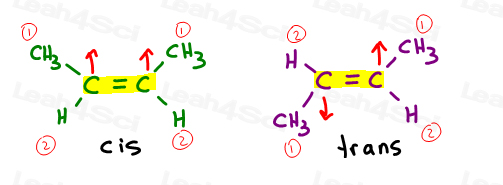
El carbono 2 y 3 tienen cada uno un grupo metilo que supera a un átomo de hidrógeno. Cuando son cis, obtienes Z. cuando son trans obtienes E.
una palabra de precaución
puedes usar E / Z para isómeros cis / trans, pero no puedes usar cis/trans para isómeros E/Z complejos como ya hemos mostrado anteriormente.,
En resumen
los isómeros CIS vs trans y E vs Z son isómeros geométricos que ocurren cuando los sustituyentes están bloqueados en posición próxima o opuesta entre sí. Esto se ve tanto en enlaces dobles para alquenos, y sustituyentes en estructuras de anillo.
los alquenos Cis están en el mismo tamaño, los alquenos trans están en lados opuestos. Cuando los sustituyentes son más complicados use la notación E/Z más avanzada después de determinar la relación de los grupos de alta prioridad.
Leave a Reply