 Ihr Kurs für organische Chemie deckt viele verschiedene Arten von Isomeren ab.
Ihr Kurs für organische Chemie deckt viele verschiedene Arten von Isomeren ab.
Isomere haben die gleiche molekulare Formel, aber etwas an ihnen ist anders.
Geometrische Isomere, eine Art Stereoisomer, unterscheiden sich in ihrer Geometrie oder Form. Dies geschieht, wenn Substituenten in einer bestimmten Beziehung zueinander gesperrt sind.,
Ich sage gesperrt, weil Sie im Gegensatz zu Konformationsisomeren in Newman-Projektionen das Molekül nicht einfach drehen können, um die Beziehung zwischen Substituenten zu ändern.
In diesem Tutorial betrachten wir geometrische Alken-Isomere einschließlich cis trans und E Z
Cis / Trans-Isomerie
Cis / Trans-Isomerie wird typischerweise mit Substituenten auf beiden Seiten der Alken-Doppelbindung gesehen.
Wie passiert das?
Alkene Doppelbindungen treten zwischen sp2 hybridisierten Kohlenstoffatomen auf. Rückruf: sp2-Hybride haben eine trigonal-planare oder „flache“ Geometrie.
(Damit nicht zufrieden?, Überprüfen sp2-Hybridisierung.)
Aber es ist nicht der Hybrid, den wir betrachten.
Stattdessen ist es das nicht hybridisierte p-Orbital, das eine ZWEITE Bindung zwischen den 2 Kohlenstoffatomen bildet.
Eine sp3-hybridisierte Einzel-oder simga-Bindung kann sich frei drehen.
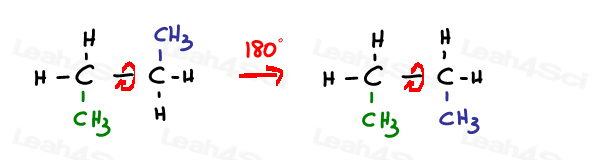
Sp2 pi-bonds sind gesperrt in Ort.
Die einzige Möglichkeit, diese Bindung zu drehen, besteht darin, die Doppelbindung zu brechen, die Doppelbindung zu drehen und zu reformieren –was normalerweise nicht beobachtet wird.
Tatsächlich erfordert dies eine hohe Energie, wie Sie später in Ihren Diels Erlenreaktionen sehen werden.,
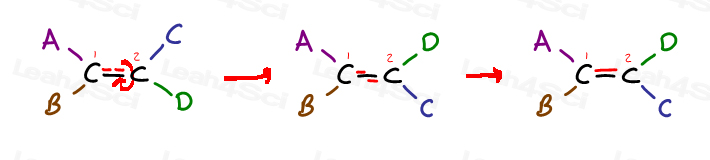
Werfen Sie einen Blick auf die folgenden generischen Alken und es ist 4 Substituenten:
Carbon 1 hat Substituenten A und B; Carbon 2 hat Substituenten C und D.
Aber beachten Sie speziell, wie A ist auf der gleichen Seite wie C, und B ist auf der gleichen Seite wie D.
Die einzige Möglichkeit, eine neben D zu bringen ist, um die Pi-Bindung zu brechen, drehen Sie das Molekül, und Reform der Pi-Bindung. Andernfalls ist A in der Nähe von C und B in der Nähe von D gesperrt.,
Cis vs Trans Alkene
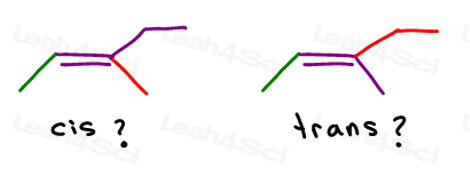
Schauen wir uns 2 Versionen von 2-Buten an: 2-Buten ist eine 4-Kohlenstoffkette mit einer Doppelbindung zwischen den Kohlenstoffnetzen 2 und 3.
Wir können dies also falsch als lineares Molekül zeichnen:
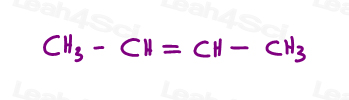
Oder zeichnen Sie jeden sp2-Kohlenstoff in einem 120-Grad-Bindungswinkel. Dies gibt mir die Möglichkeit, beide Methylgruppen nach oben, unten oder eine nach oben und eine nach unten zu platzieren.
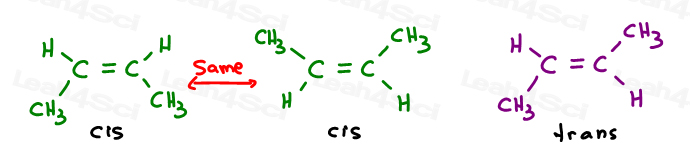
Die ersten beiden sind eigentlich das gleiche: beide cis., Sie sehen, ich kann das Molekül umdrehen und das erste überlagern (überlappen), ohne Bindungen zu brechen.
Der dritte ist eindeutig. Die einzige Möglichkeit, die dritte zu überlagern, besteht darin, die Doppelbindung zu brechen.
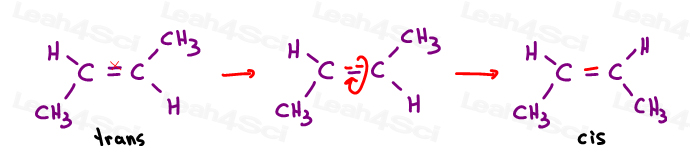
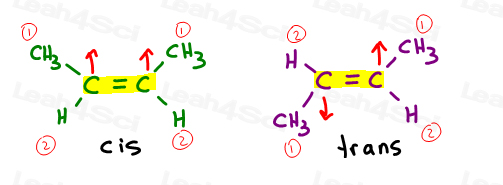
Cis Alkene
Ich mag cis als ‚Schwestern’zu denken. Sie sind zusammen auf der gleichen Seite.
Cis-Alkene haben Substituenten auf der gleichen Seite der Doppelbindung.
Trans-Alkene
Ich denke gerne an Trans-Substituenten, die sich voneinander entfernt haben.“Setzen Sie Sie auf gegenüberliegenden Seiten.,
Transalkene haben ihre Substituenten auf gegenüberliegenden Seiten.
Benennung von Cis / Trans-Alkenen:
Sobald Sie cis/trans-Alkene identifiziert haben, ist die Benennung ziemlich einfach.
1) Benennen Sie zuerst das Alken mithilfe des unten verlinkten Tutorials.
2) Dann fügen Sie einfach ‚cis“ oder „trans“ vor dem Namen.,
Nehmen Sie die 2 geometrischen Isomere von 2-Buten:
Ihre Eigennamen lauten wie folgt:
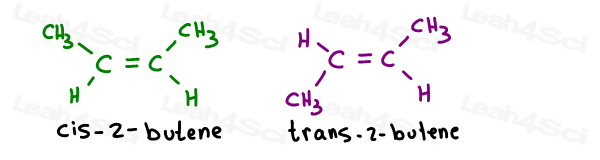
Wenn es nur eine pi-Bindung gibt, müssen Sie seitdem nicht angeben, welcher Kohlenstoff cis oder trans ist. Es ist selbstverständlich.
Wenn Sie mehr als eine Doppelbindung am Molekül haben, müssen Sie angeben, welche cis und welche trans ist.,
Nehmen Sie dieses Molekül zum Beispiel: 2,5-oktadien

Dieses Molekül hat 2 pi-Bindungen. Ein cis und ein trans.
Da es mehr als eine Pi-Bindung gibt, müssen Sie angeben, welche pi-Bindung cis und welche trans ist.
Alkenstabilität
Nicht alle Isomere haben die gleiche Stabilität.
Es geht um Stabilität – in der organischen Chemie oder Wissenschaft im Allgemeinen.

Transalkene sind STABILER als ihre cis-Gegenstücke.,
Bei größeren Substituenten ist dies deutlicher.
Transalkene
In einem Transalken sind die Substituenten einander zugewandt.
Sie don ‚T‘ get in each other s faces “ und deshalb nichts dagegen haben, den anderen Gruppen.
Cis-Alkenen
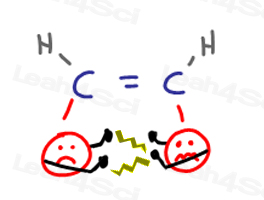 Cis-Alken Substituenten liegen nah beieinander und werden ‘erhalten, im jeweils anderen Gesichter.“Dies führt zu „Argumenten“, wenn eine Gruppe in den persönlichen Raum der anderen eindringt.
Cis-Alken Substituenten liegen nah beieinander und werden ‘erhalten, im jeweils anderen Gesichter.“Dies führt zu „Argumenten“, wenn eine Gruppe in den persönlichen Raum der anderen eindringt.
Wenn die Gruppen versuchen, sich voneinander zu entfernen, belasten sie das Molekül.,
All dies führt zu einer unglücklichen und höheren Energie cis-Konformation.
Cis & Trans auf zyklischen Verbindungen
Ringstrukturen oder zyklische Verbindungen können auch ohne Vorhandensein einer pi-Bindung cis/trans-Isomerie aufweisen.
Denken Sie daran, Substituenten werden cis und trans sein, wenn sie an Ort und Stelle gesperrt sind. Pi-Anleihen sind eine Möglichkeit, sie an Ort und Stelle zu sperren. Ringe sind eine andere Sache.
Zum Beispiel kann ich in 1,2-Dimethylcyclohexan beide Substituenten anzeigen, die in die Seite gehen, oder beide, die von der Seite ausgehen.,
Da sie in die gleiche Richtung zeigen, sind sie miteinander verbunden.
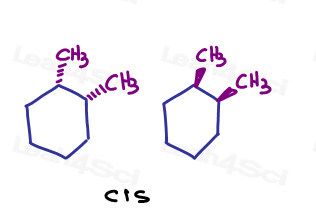
Wenn ich zeige, dass einer auf die Seite geht und einer aus der Seite geht. Sie sind miteinander verbunden.
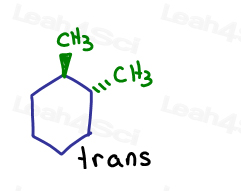
Obwohl die Kohlenstoffe sp3 und sigma aneinander gebunden sind, kann sich das Molekül selbst aufgrund der Ringstruktur nicht drehen. Sperren.
Die einzige Möglichkeit, cis-1,2-Dimethylcyclohexan in trans-1,2-dimethylcyclohexan umzuwandeln, besteht darin, den Ring aufzubrechen, zu drehen und den Ring zu reformieren.,
Was ist, wenn mehr als ein Substituent auf dem sp2-Kohlenstoff ist?
Bisher haben wir Moleküle mit nur einem Substituenten auf beiden Seiten des sp2-gebundenen Kohlenstoffs untersucht.
Was passiert, wenn wir eine pi-Bindung mit 2 verschiedenen Atomen oder Gruppen auf dem sp2-Kohlenstoff haben?
Schauen Sie sich 3-methyl-2-Penten an:
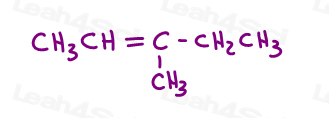
Hier in der Linienstruktur:
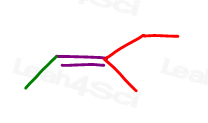
Sie können dieses Molekül auf zwei verschiedene Arten zeichnen. Aber werden Sie das rote Methyl oder rote Ethyl mit dem grünen Methyl vergleichen, wenn Sie cis oder trans wählen?,
Während einige Professoren Ihnen beibringen, die größeren Gruppen zu vergleichen, lautet die Antwort, dass Sie NICHT einfach vergleichen können Wählen Sie eine für cis und trans.
Einführung der Ez-Notation
Wenn eine Pi-Bindung mehr als einen Substituenten auf jeder Seite hat oder kohlenstofffreie Substituenten enthält, benötigen wir ein fortschrittlicheres System zur Identifizierung geometrischer Isomerie.
Das Ez-System erfordert eine Rangfolge der Gruppen auf beiden Seiten der PI-Bindung., Wir müssen feststellen, ob die Gruppen mit höherer Priorität nebeneinander liegen, Z (denken Sie cis) oder voneinander entfernt, E (denken Sie trans).
Aber zuerst müssen wir lernen, wie man Gruppen mit der Cahn-Ingold-Prelog-Notation einordnet.
Das Video unten stammt aus meiner Chirality-Serie, lehrt aber dieses Konzept im Detail. Beginnen Sie mit 0: 52
Cahn-Ingold-Prelog zusammenfassend:
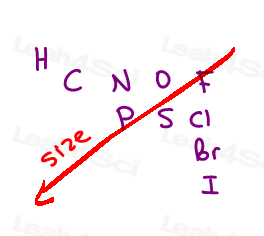
Wir ordnen Atome anhand ihrer Ordnungszahl an.
Nicht Masse der Gruppe, nicht Größe der Gruppe.
Je höher die Ordnungszahl des direkt angeschlossenen Atoms ist, desto höher ist die Priorität.,
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., Verwenden Sie Ihre Hand oder ein anderes Papier, um die andere Hälfte des Moleküls abzudecken.
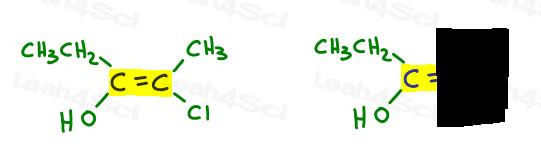
- Bestimmen Sie, welche Gruppe eine höhere Priorität hat, und geben Sie die Nummer 1 ein.
Ich zeichne gerne einen Pfeil senkrecht zur Pi-Bindung, damit ich im Vergleich deutlich sehen kann, ob er auf oder ab ist.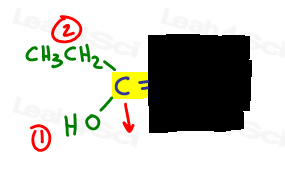
- Tun Sie dasselbe für die andere Seite.,
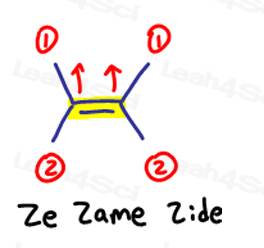
E ist für Eeposite, Z ist für Ze Zame Zide
Wenn die beiden Gruppen mit hoher Priorität einander gegenüberliegen, betrachten Sie sie als „eeposite“ zueinander.
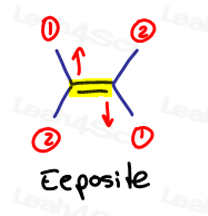 E ist für Eeposite.
E ist für Eeposite.
Wenn sich die beiden Gruppen mit hoher Priorität auf derselben Seite befinden, oder sollte ich auf ‚Ze Zame Zide‘ sagen, handelt es sich um Z.
Dies gilt für Moleküle, die mehr als nur 1 Kohlenstoff auf beiden Seiten der Doppelbindung haben.
Ze Zame Zide.,
Kehren wir zum obigen Beispiel zurück:
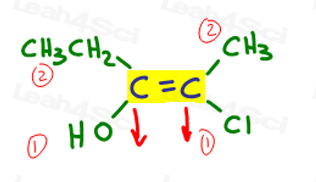
Auf der linken Seite, OH outranks, da Sauerstoff im Vergleich zu Kohlenstoff eine höhere Ordnungszahl hat. OH ist #1 und zeigt nach unten.
Auf der rechten Seite übertrifft Cl Methyl, da Chlor im Vergleich zu Kohlenstoff eine höhere Ordnungszahl hat. Cl ist #1 und zeigt nach unten.
Da beide Pfeile in die gleiche Richtung zeigen (nach unten), schließen wir, dass die Prioritätsgruppen auf Ze Zame Zide sind, so dass es Z.,
2 Gleiche Prioritätsgruppen
Manchmal sehen Sie eine Trickfrage, bei der ein sp2-Carbon 2 genau dieselben Gruppen hat.
Da Sie nicht übereinander rangieren können, wird es KEINE cis / trans-oder E / Z-Isomerie geben.
Hier sind 2 häufige Beispiele:
1) Eine Terminal-pi-Bindung
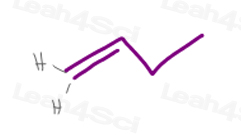
Kohlenstoff #1 in 1-Buten hat 2 Wasserstoffatome.
Da H vs H genau die gleiche Priorität haben, hat dieses Molekül keine cis/trans-oder E/Z-Isomerie.,
2) Gleiche exakte Gruppen auf demselben sp2-gebundenen Kohlenstoff.

Kohlenstoff #2 in 2-Methyl-2-Buten hat 2 CH3-Gruppen.
Einer scheint Teil der übergeordneten Kette zu sein, der zweite scheint ein Methylsubstituent zu sein.
Wenn CH3 jedoch mit CH3 verglichen wird, rangieren sie genau gleich.
Dieses Molekül hat keine cis/trans n/oder E/Z-Isomerie.,
Cis und Trans vs E und Z
Wenn wir zu unseren cis/Trans-Übungsproblemen wie cis und trans 2-Buten zurückkehren, werden Sie sehen, dass wir auch hier das E / Z-System verwenden können.
Kohlenstoff 2 und 3 haben jeweils eine Methylgruppe, die einem Wasserstoffatom überlegen ist. Wenn sie cis sind, erhalten Sie Z. Wenn sie trans sind, erhalten Sie E.
Ein Wort der Vorsicht
Sie KÖNNEN E/Z für cis/trans-Isomere verwenden, aber Sie können nicht verwenden cis/trans für komplexe E / Z-Isomere, wie wir bereits oben gezeigt haben.,
Zusammenfassend
Cis vs trans-und E vs Z-Isomere sind geometrische Isomere, die auftreten, wenn Substituenten in Position neben oder gegenübereinander gesperrt sind. Dies wird sowohl in Doppelbindungen für Alkene als auch in Substituenten an Ringstrukturen gesehen.
Cis-Alkene sind gleich groß, Trans-Alkene auf gegenüberliegenden Seiten. Wenn die Substituenten komplizierter sind, verwenden Sie die fortgeschrittenere E/Z-Notation, nachdem Sie die Beziehung von Gruppen mit hoher Priorität bestimmt haben.
Leave a Reply