 cursul dvs. de chimie organică va acoperi multe tipuri diferite de izomeri.
cursul dvs. de chimie organică va acoperi multe tipuri diferite de izomeri.
izomerii au aceeași formulă moleculară, dar ceva despre ei este diferit.
izomerii geometrici, un tip de stereoizomer, diferă în geometria sau forma lor. Acest lucru se întâmplă atunci când substituenții sunt blocați într-o relație specifică între ei.,
spun blocat deoarece, spre deosebire de izomerii conformaționali din proiecțiile Newman, nu puteți roti pur și simplu molecula pentru a schimba relația dintre substituenți.
În acest tutorial, ne vom uita la alchene geometrice inclusiv izomerii cis și trans E Z.
Cis/Trans Izomerie
Cis/Trans izomerie este de obicei văzut cu substituenți de pe fiecare parte a alchene legătură dublă.
cum se întâmplă acest lucru?
legături duble alchene apar între atomii de carbon hibridizați sp2. Reamintim: hibrizii sp2 au o geometrie trigonală-plană sau „plană”.
(nu este confortabil cu asta?, Revizuirea hibridizare sp2.)
dar nu este hibridul la care ne uităm.
În schimb, este orbitalul p ne-hibridizat care formează o a doua legătură între cei 2 atomi de carbon.
o legătură unică hibridizată sp3 sau simga este liberă să se rotească.
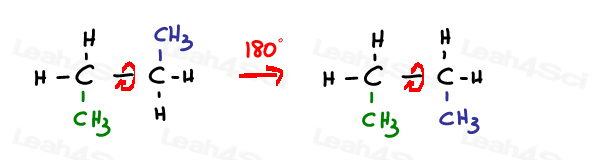
legăturile Sp2 pi sunt blocate în loc.singura modalitate de a roti această legătură este de a rupe legătura dublă, de a roti și de a reforma legătura dublă –ceea ce nu este de obicei observat.de fapt, acest lucru necesită energie ridicată, așa cum veți vedea în reacțiile Diels Alder mai târziu.,
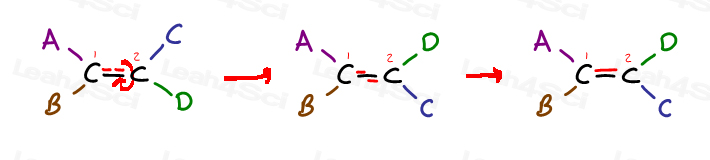
Ia o privire la următoarele generic alchene și 4 substituenți:
de Carbon 1 a substituenților a și B; de Carbon a 2-a are substituenți C și D.
Dar observa exact cum este pe aceeași parte ca și C, și B se află pe aceeași parte ca D.
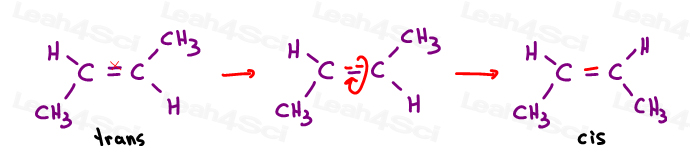
singurul mod de a aduce O lângă D este de a rupe pi bond, roti molecula, și reforma pi bond. În caz contrar, A este blocat în loc lângă C, iar B este blocat în loc lângă D.,
Csi vs Trans Alchene
Să aruncăm o privire la 2 versiuni de 2-butenă: 2-butena este un 4-lanț de carbon cu o legătură dublă între atomi de carbon 2 și 3.deci, putem desena acest lucru incorect, ca o moleculă liniară:
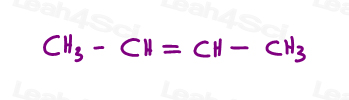
sau, desenați fiecare carbon sp2 la un unghi de legătură de 120 de grade. Acest lucru îmi oferă opțiunea de a plasa ambele grupări metil în sus, în jos sau una în sus și una în jos.
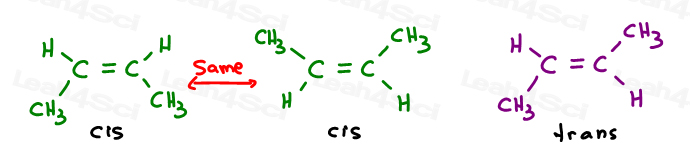
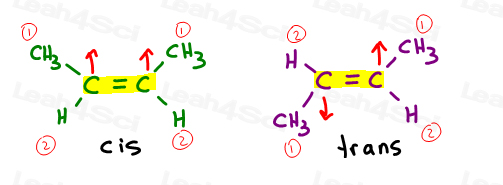
primele două sunt de fapt aceleași: ambele CSI., Vedeți, pot răsturna molecula și să fac prima suprapunere (suprapunere) a doua fără a rupe nicio legătură.al treilea este unic. Singura modalitate de a suprapune a treia este de a rupe legătura dublă.
alchene Cis
îmi place să cred că cis ca „surori”. Sunt împreună pe aceeași parte.
alchenele Cis au substituenți pe aceeași parte a legăturii duble.
alchene Trans
îmi place să mă gândesc la substituenții trans ca fiind ” transferați unul de celălalt.”Punându-le pe părți opuse.,
alchenele Trans au substituenții lor pe laturile opuse.
denumirea alchenelor Cis / Trans:
odată ce ați identificat alchenele cis/trans, denumirea lor este destul de simplă.
1) mai întâi, denumiți alchena folosind tutorialul legat mai jos.
2) apoi, pur și simplu adăugați ” cis ” sau „trans” în fața numelui.,
Ia 2 izomeria geometrică a 2-butenă:
nume proprii sunt după cum urmează:
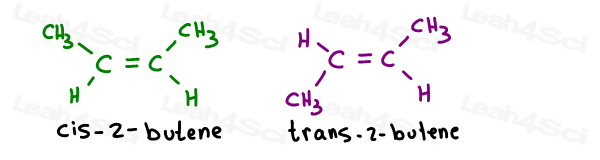
atunci Când există doar un singur pi bond, nu trebuie să specificați care de carbon este cis sau trans atunci. Se înțelege de la sine.când aveți mai mult de o legătură dublă pe moleculă, trebuie să specificați care este cis și care este trans.,
Ia această moleculă de exemplu: 2,5-octadiene

Această moleculă are 2 pi obligațiuni. Un cis și un trans.deoarece există mai mult de o legătură pi, trebuie să specificați care legătură pi este cis și care este trans.
stabilitatea alchenelor
nu toți izomerii au aceeași stabilitate. este vorba despre stabilitate-în chimia organică sau știința în general.

alchenele Trans sunt mai stabile decât omologii lor cis.,
Acest lucru este mai evident cu substituenții mai mari.
alchene Trans
într-o alchenă trans, substituenții sunt orientați unul față de celălalt.
ei nu „intra în fețele celuilalt” și, prin urmare, nu minte celelalte grupuri.
alchene Cis
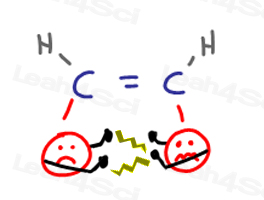 substituenții alchene Cis sunt aproape împreună și va ‘primi în fiecare alte fețe.”Acest lucru provoacă „argumente” atunci când un grup invadează spațiul personal al celuilalt.când grupurile încearcă să se îndepărteze unul de celălalt, ele provoacă tulpina asupra moleculei.,toate acestea conduc la o conformație energetică CIS nefericită și mai mare.
substituenții alchene Cis sunt aproape împreună și va ‘primi în fiecare alte fețe.”Acest lucru provoacă „argumente” atunci când un grup invadează spațiul personal al celuilalt.când grupurile încearcă să se îndepărteze unul de celălalt, ele provoacă tulpina asupra moleculei.,toate acestea conduc la o conformație energetică CIS nefericită și mai mare.
Csi & Trans pe Ciclice Compuși
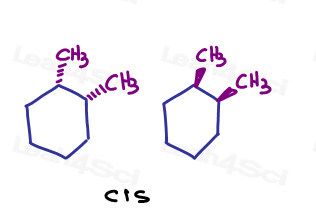
structuri inelare sau ciclic compuși pot prezenta, de asemenea, cis/trans izomerie fără prezența unui pi bond. amintiți-vă, substituenții vor fi cis și trans dacă sunt blocați pe loc. Obligațiuni Pi sunt o modalitate de a le bloca în loc. Inelele sunt o altă problemă.de exemplu ,în 1,2-dimetilciclohexan, pot arăta ambii substituenți care intră în pagină sau ambii ieșind din pagină.,
deoarece acestea sunt îndreptate în aceeași direcție, ele sunt cis unul de altul.
dacă afișez una care intră în pagină și una care iese din pagină. Ele sunt trans reciproc.
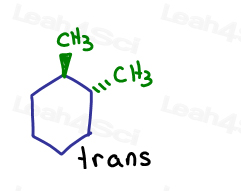
chiar dacă carbonii sunt legați sp3 și sigma unul de celălalt, molecula însăși nu se poate roti din cauza structurii inelului. Blocat.singura modalitate de a transforma cis-1,2-dimetilciclohexanul în trans-1,2-dimetilciclohexan este de a deschide inelul, de a roti și de a reforma inelul.,
ce se întâmplă dacă există mai mulți substituenți pe carbonul sp2?
până acum, ne-am uitat la molecule cu un singur substituent pe fiecare parte a carbonului legat de sp2 pi.ce se întâmplă dacă avem o legătură pi cu 2 atomi sau grupuri diferite pe carbonul sp2?
uită-te la 3-metil-2-pentene:
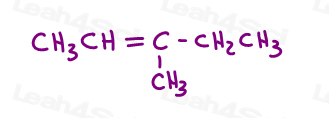
Aici, în linie structură:
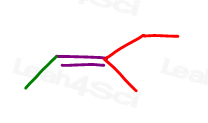
puteți desena această moleculă în 2 moduri diferite. Dar veți compara metilul roșu sau etilul roșu cu metilul verde atunci când alegeți cis sau trans?,
în timp ce unii profesori vă vor învăța să comparați grupurile mai mari, răspunsul este că nu puteți compara pur și simplu alegeți unul pentru cis și trans.
introducerea notației E Z
când o legătură pi are mai mult de un substituent pe fiecare parte sau conține substituenți non-carbon, vom avea nevoie de un sistem mai avansat pentru identificarea izomerismului geometric.
sistemul E Z necesită clasarea grupurilor de pe fiecare parte a legăturii pi., Trebuie să determinăm dacă grupurile prioritare superioare sunt unul lângă celălalt, Z (gândiți-vă cis) sau departe unul de celălalt, E (gândiți-vă trans).
dar mai întâi, trebuie să învățăm cum să clasificăm grupurile folosind notația Cahn-Ingold-Prelog.
videoclipul de mai jos este din seria mea chirality, dar învață acest concept în detaliu. Începeți să urmăriți de la 0:52
Cahn-Ingold-Prelog în rezumat:
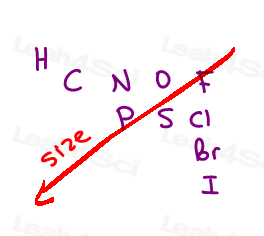
clasificăm atomii în funcție de numărul lor atomic.
Nu masa grupului, nu dimensiunea grupului.cu cât este mai mare numărul atomic al atomului atașat direct, cu atât este mai mare prioritatea.,
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., Utilizați mâna sau o altă hârtie pentru a acoperi cealaltă jumătate a moleculei.
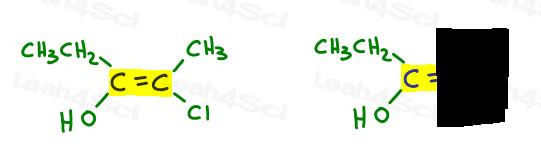
- determinați ce grup are prioritate mai mare și puneți un număr 1.
îmi place să desenez o săgeată perpendiculară pe legătura pi, astfel încât să pot vedea clar dacă este în sus sau în jos prin comparație.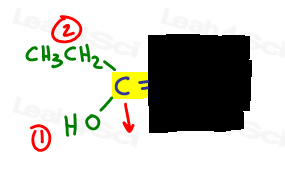
- Face același lucru pentru cealaltă parte.,
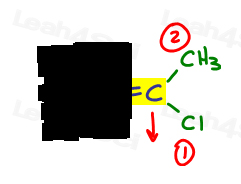
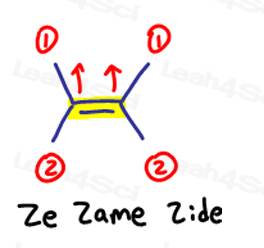
E este pentru Eeposite, Z este pentru Ze Zame Spirounias
Dacă cele două mari grupuri prioritare sunt opuse unul altuia, cred că de ei ca fiind ‘eeposite la fiecare alte.
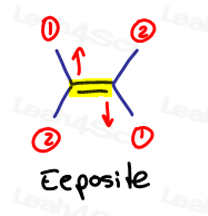 E este pentru Eeposite.dacă cele două grupuri cu prioritate ridicată sunt pe aceeași parte sau ar trebui să spun pe „Ze Zame Zide”, acestea sunt Z.
E este pentru Eeposite.dacă cele două grupuri cu prioritate ridicată sunt pe aceeași parte sau ar trebui să spun pe „Ze Zame Zide”, acestea sunt Z.
Acest lucru se aplică moleculelor care au mai mult de 1 carbon pe fiecare parte a legăturii duble.
Ze Zame Zide.,
să ne întoarcem la exemplul de mai sus:
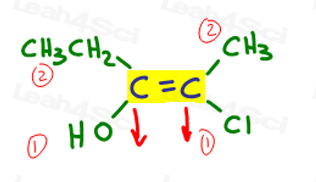
în stânga, O depășește etilic, deoarece oxigenul are o mai mare numărul atomic comparativ cu carbon. OH este #1 și puncte în jos.în partea dreaptă, Cl depășește metilul, deoarece clorul are un număr atomic mai mare în comparație cu carbonul. Cl este #1 și puncte în jos.deoarece ambele săgeți indică în aceeași direcție( în jos), concluzionăm că grupurile prioritare sunt pe Ze Zame Zide făcându-l Z.,
2 grupuri cu prioritate egală
uneori veți vedea o întrebare capcană în care un carbon sp2 va avea 2 din aceleași grupuri.deoarece nu puteți clasifica unul peste celălalt, nu va exista izomerism cis/trans sau e/Z.
Aici sunt 2 exemple comune:
1) Un terminal pi bond
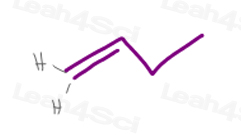
de Carbon #1 în 1-butena are 2 atomi de hidrogen.
deoarece H vs H au aceeași prioritate exactă, această moleculă nu va avea izomerism cis/trans sau e / Z.,
2) aceleași grupuri exacte pe același carbon legat sp2 pi.

de Carbon #2 în 2-metil-2-butena are 2 CH3 grupuri.
unul pare să facă parte din lanțul parental, al doilea pare să fie un substituent metil.
Cu toate acestea, atunci când CH3 este comparat cu CH3 ei rang Exact la fel.
această moleculă nu va avea izomerism cis/trans n/sau e/Z.,
Cis și Trans vs E și Z
dacă ne întoarcem la problemele noastre de practică cis / trans, cum ar fi cis și trans 2-butene, veți vedea că putem folosi și sistemul E/Z aici.
carbonul 2 și 3 au fiecare o grupare metil care depășește un atom de hidrogen. Când sunt cis, obțineți Z. Când sunt trans, obțineți E.
un cuvânt de precauție
puteți utiliza E / Z pentru izomerii cis / trans, dar nu puteți utiliza cis/trans pentru izomerii complexi E/Z așa cum am arătat deja mai sus.,
în rezumat
izomerii Cis vs trans și e vs Z sunt izomeri geometrici care apar atunci când substituenții sunt blocați în poziție unul lângă celălalt sau unul față de celălalt. Acest lucru se observă atât în legăturile duble pentru alchene, cât și în substituenții pe structurile inelare.alchenele Cis sunt de aceeași dimensiune, alchenele trans sunt pe laturile opuse. Când substituenții sunt mai complicați, utilizați notația E/Z mai avansată după determinarea relației grupurilor cu prioritate ridicată.
Leave a Reply