okresowe trendy
najpierw skupimy się na poszczególnych atomach i zastanowimy się nad trendami związanymi z pozycją pierwiastka w układzie okresowym. Użyjemy jako naszych pierwszych modeli prostych związków organicznych etanu, metyloaminy i metanolu, ale pojęcia te odnoszą się w równym stopniu do bardziej złożonych biomolekuł, takich jak łańcuchy boczne alaniny, lizyny i seryny.,
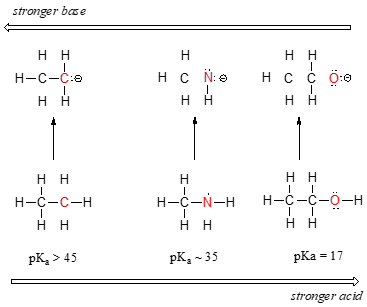
widzimy wyraźny trend kwasowości, przechodząc od lewej do prawej wzdłuż drugiego rzędu układu okresowego z węgla do azotu do tlenu. Kluczem do zrozumienia tego trendu jest rozważenie hipotetycznej Zasady sprzężonej w każdym przypadku: im bardziej stabilna (słabsza) zasada sprzężona, tym silniejszy kwas. Spójrz, gdzie ładunek ujemny kończy się w każdej bazie sprzężonej., W anionie etylowym ładunek ujemny jest przenoszony przez węgiel, podczas gdy w anionie metyloaminowym i anionie metoksylowym ładunki znajdują się odpowiednio na azocie i tlenu. Pamiętajmy o okresowym trendzie w elektroenergetyce: wzrasta on również w miarę przesuwania się od lewej do prawej wzdłuż rzędu, co oznacza, że tlen jest najbardziej elektronowy z trzech, a węgiel najmniej. Im bardziej elektronegatywny atom, tym lepiej jest w stanie wytrzymać ładunek ujemny., Tak więc anion metoksydowy jest najbardziej stabilny (najniższa energia, najmniej zasadowa) z trzech koniugowanych zasad, a anion etylowy jest najmniej stabilny (najwyższa energia, najbardziej zasadowa).
możemy użyć tego samego zestawu pomysłów, aby wyjaśnić różnicę w zasadowości wody i amoniaku.
patrząc na pkavalu dla odpowiednich koniugatów kwasów, wiemy, że amoniak jest bardziej zasadowy niż woda. Tlen, jako pierwiastek bardziej elektronegatywny, trzyma się szczelniej swojej samotnej pary niż azot., W związku z tym wolna para azotu jest bardziej podatna na zerwanie i utworzenie nowego wiązania z protonem – innymi słowy, jest bardziej podstawowa. Po raz kolejny, bardziej reaktywna (silniejsza) koniugowana zasada oznacza mniej reaktywny (słabszy) sprzężony kwas.
poruszając się pionowo w obrębie danej kolumny układu okresowego, ponownie obserwujemy wyraźny okresowy trend kwasowości. Jest to najlepiej zilustrowane halogenkami: zasadowość, podobnie jak elektroenergetyczność, wzrasta wraz z poruszaniem się w górę kolumny.,

odwrotnie, kwasowość w halokwasach wzrasta, gdy przesuwamy się w dół kolumny.
aby zrozumieć ten trend, ponownie rozważymy stabilność koniugowanych baz. Ponieważ fluor jest najbardziej elektronegatywnym pierwiastkiem halogenowym, możemy oczekiwać, że fluor będzie również najmniej podstawowym Jonem halogenowym. Ale w rzeczywistości jest najmniej stabilny i najbardziej podstawowy! Okazuje się, że poruszając się pionowo w układzie okresowym, wielkość atomu przewyższa jego elektroujemność w odniesieniu do zasadowości., Promień atomowy jodu jest około dwa razy większy niż fluoru, więc w Jonie jodu ładunek ujemny jest rozłożony na znacznie większą objętość:

ilustruje to fundamentalną koncepcję w chemii organicznej, która jest wystarczająco ważna, aby umieścić czerwony:
ładunki elektrostatyczne, dodatnie lub ujemne, są bardziej stabilne, gdy są „rozłożone”, niż gdy są ograniczone do jednego atomu.,
będziemy widzieć tę ideę wyrażoną wielokrotnie w naszych badaniach reaktywności organicznej, w wielu różnych kontekstach. Na razie pojęcie to stosuje się tylko do wpływu promienia atomowego na stabilność anionów. Ponieważ fluor jest najmniej stabilny (najbardziej zasadowy) z koniugowanych zasad halogenkowych, HF jest najmniej kwaśny z halokwasów, tylko nieco silniejszy niż kwas octowy. Witam, z pKa około -9, jest jednym z najsilniejszych kwasów znanych.
co ważniejsze do badania biologicznej chemii organicznej, ten trend mówi nam, że tiole są bardziej kwaśne niż alkohole., Na przykład pKa grupy tiolowej na łańcuchu bocznym cysteiny wynosi około 8,3, podczas gdy PKA dla hydroksla na łańcuchu bocznym seryny jest rzędu 17.
aby powtórzyć: wytrzymałość kwasu wzrasta, gdy przesuwamy się w prawo wzdłuż rzędu układu okresowego, a gdy przesuwamy się w dół kolumny.
narysuj strukturę sprzężonej zasady, która utworzyłaby się, gdyby związek poniżej reagował z 1 molowym odpowiednikiem wodorotlenku sodu:
roztwór
efekt rezonansu
w poprzedniej części skupiliśmy naszą uwagę na okresowych trendach – różnicach kwasowości i zasadowości między grupami, w których wymienny Proton był związany z różnymi pierwiastkami., Teraz nadszedł czas, aby zastanowić się, w jaki sposób struktura różnych grup organicznych przyczynia się do ich względnej kwasowości lub zasadowości, nawet jeśli mówimy o tym samym pierwiastku działającym jako donor/akceptor protonu. Pierwszą parą modeli, którą rozważymy, jest etanol i kwas octowy, ale wnioski, do których dojdziemy, będą równie ważne dla wszystkich grup alkoholi i kwasów karboksylowych.
pomimo faktu, że oba są kwasami tlenowymi, wartości pKa etanolu i kwasu octowego są bardzo różne. Co sprawia, że kwas karboksylowy jest o wiele bardziej kwaśny niż alkohol?, Tak jak poprzednio, zaczynamy od rozważenia podstaw koniugacji.
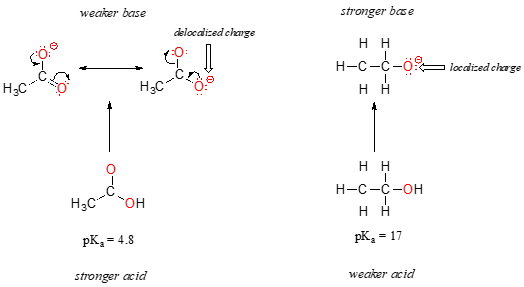
u obu gatunków ładunek ujemny na sprzężonej podstawie jest utrzymywany przez tlen, więc okresowe trendy nie mogą być wywoływane. W przypadku kwasu octowego istnieje jednak zasadnicza różnica: można narysować rezonans, w którym ładunek ujemny znajduje się na drugim tlenu grupy. Dwie formy rezonansowe dla sprzężonej bazy są równe pod względem energii, zgodnie z naszymi „zasadami rezonansu”., Co to oznacza, można sobie przypomnieć, Jest to, że ujemny ładunek na Jonie octanu nie znajduje się na jednym lub drugim tlenu: raczej jest dzielony między nimi. Chemicy używają terminu „delokalizacja ładunku” do opisania tej sytuacji. Natomiast w Jonie etoksydowym ładunek ujemny jest „zablokowany” na pojedynczym tlen – nie ma on dokąd pójść.,
nadszedł czas, aby przypomnieć sobie to stwierdzenie z poprzedniej sekcji, które było tak ważne, że zostało wydrukowane pogrubioną czcionką we własnym akapicie – w rzeczywistości jest to tak ważne, że po prostu powtórzymy to jeszcze raz: „ładunki elektrostatyczne, czy to pozytywne, czy negatywne, są bardziej stabilne, gdy są „rozłożone” niż gdy są ograniczone do jednego atomu.”Teraz widzimy tę koncepcję w innym kontekście, gdzie ładunek jest 'rozłożony' (innymi słowy, delokalizowany) przez rezonans, a nie po prostu przez rozmiar zaangażowanego atomu.,
delokalizacja ładunku przez rezonans ma bardzo silny wpływ na reaktywność cząsteczek organicznych, wystarczy, aby uwzględnić różnicę ponad 12 jednostek pKa między etanolem a kwasem octowym (i pamiętaj, pKa jest wyrażeniem log, więc mówimy o różnicy ponad 1012 między stałymi kwasowości dla dwóch cząsteczek). Jon octanowy jest o wiele bardziej stabilny niż jon etoksydowy, wszystko dzięki efektom delokalizacji rezonansu.,
efekt rezonansu również ładnie wyjaśnia, dlaczego atom azotu jest zasadowy, gdy jest w aminie, ale nie zasadowy, gdy jest częścią grupy amidowej. Przypomnijmy, że w amidzie istnieje znaczący charakter wiązania podwójnego węgiel-azot, ze względu na drugi czynnik rezonansowy, w którym para azotu jest częścią wiązania P.
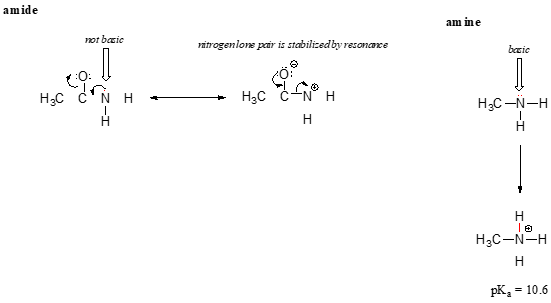
podczas gdy para elektronowa azotu Amin jest „zablokowana” w jednym miejscu, samotna para azotu amidowego jest delokalizowana przez rezonans., Zauważ, że w tym przypadku rozszerzamy nasze centralne twierdzenie, aby powiedzieć, że gęstość elektronów – w postaci samotnej pary-jest stabilizowana przez delokalizację rezonansową, nawet jeśli nie ma ujemnego ładunku. Oto inny sposób myślenia o tym: samotna para na amidowym azocie nie jest dostępna do wiązania z protonem – te dwa elektrony są zbyt „wygodne” będąc częścią zdelokalizowanego układu wiązania pi. Para samotna na azocie Amin, z kolei, nie jest częścią zdelokalizowanego układu p i jest bardzo gotowa do utworzenia wiązania z dowolnym kwaśnym protonem, który może być w pobliżu.,
często wymaga starannego przemyślenia, aby przewidzieć najbardziej kwaśny proton na cząsteczce. Kwas askorbinowy, znany również jako witamina C, ma pKa 4,1.
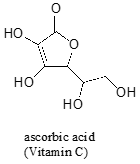
na tej cząsteczce znajdują się cztery grupy hydroksylowe – która z nich jest najbardziej kwaśna? Jeśli rozważymy wszystkie cztery możliwe sprzężone zasady, to okaże się, że istnieje tylko jedna, dla której możemy rozdzielić ładunek ujemny na dwa atomy tlenu.
uszereguj poniższe związki od najbardziej kwaśnych do najmniej kwaśnych i wyjaśnij swoje rozumowanie.,c3a3fdb788″>
rozwiązanie
efekt indukcyjny
porównaj wartości PKA kwasu octowego i jego mono-, di-i Tri-chlorowanych pochodnych:
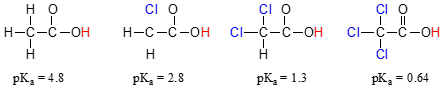
obecność chloryn wyraźnie zwiększa kwasowość grupy kwasów karboksylowych, ale argument tutaj nie ma nic wspólnego z delokalizacji rezonansowej, ponieważ nie dla chlorowanych cząsteczek można wyciągnąć dodatkowe wkłady rezonansowe., Raczej wyjaśnienie tego zjawiska wiąże się z czymś zwanym efektem indukcyjnym. Atom chloru jest bardziej elektronowy niż wodór, a zatem jest w stanie „indukować” lub „przyciągać” gęstość elektronów do siebie, z dala od grupy karboksylowej. W efekcie atomy chloru pomagają w dalszym rozłożeniu gęstości elektronowej sprzężonej zasady, co, jak wiemy, ma działanie stabilizujące. W tym kontekście podstawnik chloru nazywany jest grupą wycofującą elektrony., Zauważ, że efekt obniżający pKa każdego atomu chloru, choć znaczący, nie jest tak dramatyczny, jak efekt delokalizującego rezonansu ilustrowany różnicą wartości pKa między alkoholem a kwasem karboksylowym. Ogólnie rzecz biorąc, efekty rezonansowe są silniejsze niż efekty indukcyjne.
indukcyjny efekt wycofywania elektronów przez chloriny odbywa się poprzez wiązania kowalencyjne, a jego wpływ zmniejsza się znacznie z odległością-tak więc chlor oddalony o dwa węgle od grupy kwasów karboksylowych ma zmniejszony efekt w porównaniu do chloru oddalonego tylko o jeden węgiel.
Leave a Reply