周期的傾向
まず、個々の原子に焦点を当て、周期表上の元素の位置に関連する傾向について考えます。 最初のモデルとして、単純な有機化合物エタン、メチルアミン、メタノールを使用しますが、この概念は、アラニン、リジン、セリンの側鎖など、より複雑な生体分子にも同様に適用されます。,
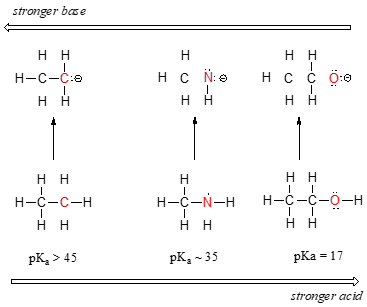
私たちは、炭素から窒素、酸素に周期表の第二の行に沿って左から右に移動すると、酸性度の明確な傾向を見ることができます。 この傾向を理解するための鍵は、それぞれの場合における仮説的な共役塩基を考慮することである:共役塩基がより安定(弱い)であればあるほど、酸 負電荷が各共役塩基で終わる場所を見てください。, エチルアニオンでは負電荷は炭素によって担われ,メチルアミンアニオンとメトキシドアニオンでは電荷はそれぞれ窒素と酸素に位置する。 電気陰性度の周期的な傾向を覚えておいてください:それはまた、酸素が三つの中で最も電気陰性であり、炭素が最も少ないことを意味し、行に沿って左から右に移動するにつれて増加します。 原子が電気陰性であるほど、負電荷を負担することができます。, したがって、メトキシドアニオンは三つの共役塩基の中で最も安定(最低エネルギー、最も塩基性)であり、エチルアニオンは最も安定(最高エネルギー、最も塩基性)である。
水とアンモニアの塩基度の違いを説明するために、同じアイデアセットを使用することができます。
適切な共役酸のpKavaluesを見ると、アンモニアは水よりも塩基性であることがわかります。 酸素は、より電気陰性の要素として、窒素よりもその孤立対によりしっかりと保持されます。, したがって、窒素の孤立電子対は、壊れてプロトンと新しい結合を形成する可能性が高くなります-それは、言い換えれば、より基本的です。 もう一度、より反応性の高い(より強い)共役塩基は、反応性の低い(より弱い)共役酸を意味する。
周期表の特定の列内を垂直に移動すると、酸性度の明確な周期的傾向が再び観察されます。 これはハロゲン化物で最もよく示されています:塩基度は、電気陰性度のように、列を上に移動するにつれて増加します。,

逆に、ハロ酸の酸性度は列を下に移動するにつれて増加します。
この傾向を理解するために、共役塩基の安定性をもう一度検討する。 フッ素は最も電気陰性のハロゲン元素であるため、フッ化物も最も塩基性のハロゲンイオンであると予想されるかもしれません。 しかし、実際には、それは最も安定していない、そして最も基本的なものです! 周期表の中で垂直に移動すると、原子の大きさは塩基度に関して電気陰性度を切り札にすることが分かります。,

これは、有機化学における基本的な概念を示しています。
静電荷、正または負それらが一つの原子に閉じ込められているときよりも”広がっている”ときより安定である。,
このアイデアは、多くの異なる文脈で、有機反応性の研究を通して何度も何度も表現されています。 今のところ、この概念は、アニオン安定性に対する原子半径の影響にのみ適用されます。 フッ化物はハロゲン化物共役塩基の中で最も安定ではない(最も塩基性)ので、HFはハロ酸の中で最も酸性であり、酢酸よりもわずかに強い。 こんにちは、約-9のpKaで、知られている最強の酸です。
生物学的有機化学の研究にとってもっと重要なことは、この傾向はチオールがアルコールよりも酸性であることを示している。, 例えば、システイン側鎖上のチオール基のpKaは約8.3であり、セリン側鎖上のヒドロキシルのpKaは17オーダーである。
繰り返します:酸強度は、周期表の行に沿って右に移動し、列を下に移動するにつれて増加します。
以下の化合物が1モル当量の水酸化ナトリウムと反応する場合に形成される共役塩基の構造を描く:
溶液
共鳴効果
前のセクションでは、交換可能なプロトンが異なる要素に結合していたグループ間の酸性度と塩基度の違いに注目しました。, さて、異なる有機基の構造が、プロトンドナー/アクセプターとして作用する同じ元素について話している場合でも、それらの相対的な酸性度または塩基性度にどのように寄与するかについて考える時が来ました。 我々が検討する最初のモデルペアはエタノールと酢酸であるが、我々が到達する結論はすべてのアルコールおよびカルボン酸基に対して同様に有効である。
それらは両方とも酸素酸であるという事実にもかかわらず、エタノールと酢酸のpKa値は非常に異なっている。 カルボン酸をアルコールよりもはるかに酸性にするのは何ですか?, 前と同じように、我々は共役塩基を考慮することから始める。
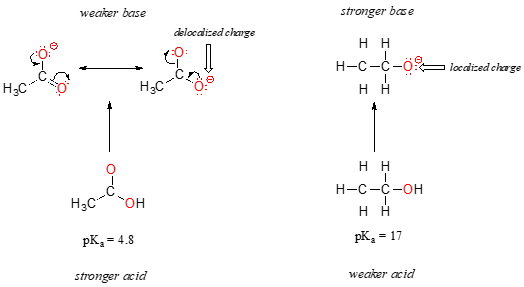
両方の種では、共役塩基上の負電荷は酸素によって保持されるため、周期的な傾向を呼び出すことはできません。 しかし、酢酸の場合、重要な違いがあります:負電荷がグループの第二の酸素に局在する共鳴寄与者を引き出すことができます。 共役塩基に対する二つの共鳴形式は,我々の”共鳴の規則”に従って,エネルギーが等しい。, これが意味することは、あなたが思い出すかもしれませんが、酢酸イオンの負電荷は一方の酸素または他方の酸素に位置していないということです。 化学者は、この状況を記述するために”電荷の非局在化”という用語を使用する。 対照的に、エトキシドイオンでは、負電荷は単一の酸素に”ロック”されています–それはどこにも行くことがありません。,
さて、前のセクションからのその声明に戻って考える時間です–実際には、私たちはちょうど再びそれを言うことが非常に重要です:”静電気は、正または負のかどうか、彼らは一つの原子に閉じ込められているときよりも、彼らは”広がっている”ときに、より安定しています。”今、私たちは、電荷が単に関与する原子の大きさではなく、共鳴によって”広がって”(言い換えれば、非局在化)されている別の文脈でこの概念を見ています。,
共鳴による電荷の非局在化は、エタノールと酢酸の間の12以上のpKa単位の違いを説明するのに十分な有機分子の反応性に非常に強力な効果を有する(pKaは対数式であるため、二つの分子の酸度定数の間の1012以上の違いについて話している)。 酢酸イオンはエトキシドイオンよりもはるかに安定であり、すべて共鳴非局在化の効果による。,
共鳴効果はまた、窒素原子がアミン中にあるときは塩基性であるが、アミド基の一部であるときは塩基性ではない理由をうまく説明する。 アミドにおいて、窒素非共鳴対がp結合の一部である第二の共鳴寄与者のために、炭素-窒素結合に有意な二重結合特性があることを思い出してください。
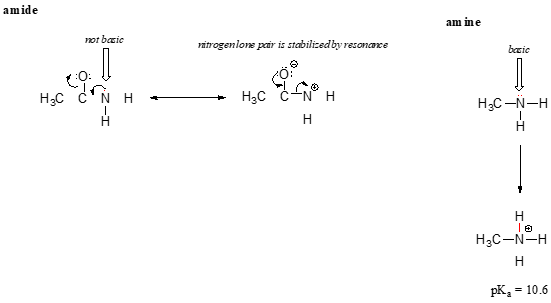
アミン窒素の電子孤立電子対が一箇所に”スタック”している間、アミド窒素上の孤立電子対は共鳴によって非局在化される。, この場合、負電荷が関与していないにもかかわらず、孤立電子対の形で電子密度が共鳴非局在化によって安定化されると言うために、中心的な声明を拡張していることに注意してください。 ここではそれについて考える別の方法です:アミド窒素上の孤立電子対はプロトンとの結合には利用できません–これら二つの電子は非局在化pi結合システムの一部であることがあまりにも”快適”です。 対照的に、アミン窒素上の孤立対は非局在化p系の一部ではなく、近くにあるかもしれない酸性プロトンと結合を形成する準備ができている。,
多くの場合、分子上で最も酸性のプロトンを予測するためには慎重な考えが必要です。 ビタミンCとしても知られているアスコルビン酸は、4.1のpKaを有する。
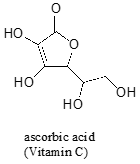
この分子には四つのヒドロキシル基があります–どれが最も酸性ですか? 四つの可能な共役塩基をすべて考えると,二つの酸素原子上で負電荷を非局在化できるのは一つだけであることが分かった。
以下の化合物を最も酸性から少なくとも酸性にランク付けし、あなたの推論を説明してください。,c3a3fdb788″>
ソリューション
帰納効果
酢酸のpKa値とそのモノ-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di-、di–、および三塩素化誘導体:
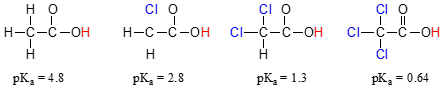
塩素の存在は明らかにカルボン酸基の酸性度を増加させるが、ここでの議論は、塩素化分子に対して追加の共鳴寄与者を引き出すことができないため、共鳴非局在化とは関係ない。, むしろ、この現象の説明には、帰納効果と呼ばれるものが含まれます。 塩素原子は水素よりも電気陰性であり、したがって、カルボン酸基から電子密度を”誘導”または”引き出す”ことができる。 実際には、塩素原子は、我々が知っているように安定化効果を有する共役塩基の電子密度をさらに広げるのに役立っている。 この文脈では、塩素置換基は電子吸引基と呼ばれる。, 各塩素原子のpka低下効果は有意であるが,アルコールとカルボン酸の間のpka値の差によって示される非局在共鳴効果ほど劇的ではないことに注意してください。 一般に、共鳴効果は誘導効果よりも強力である。
塩素の誘導電子吸引効果は共有結合によって起こり、その影響は距離とともに著しく減少する–したがって、カルボン酸基から二つの炭素が離れ
Leave a Reply