 Il tuo corso di chimica organica coprirà molti diversi tipi di isomeri.
Il tuo corso di chimica organica coprirà molti diversi tipi di isomeri.
Gli isomeri hanno la stessa formula molecolare ma qualcosa su di essi è diverso.
Gli isomeri geometrici, un tipo di stereoisomero, differiscono nella loro geometria o forma. Ciò accade quando i sostituenti sono BLOCCATI in una relazione specifica l’uno con l’altro.,
Dico bloccato perché, a differenza degli isomeri conformazionali nelle proiezioni di Newman, non puoi semplicemente ruotare la molecola per cambiare la relazione tra i sostituenti.
In questo tutorial, vedremo gli isomeri geometrici alchenici tra cui cis trans ed E Z.
Isomerismo Cis/Trans
L’isomerismo cis/Trans è tipicamente visto con sostituenti su entrambi i lati del doppio legame alchenico.
Come succede?
I doppi legami alchenici si verificano tra atomi di carbonio ibridati sp2. Ricordiamo: gli ibridi sp2 hanno una geometria trigonale-planare o “piatta”.
(Non è a suo agio con questo?, Revisione Ibridazione sp2.)
Ma non è l’ibrido che stiamo guardando.
Invece, è il p-orbitale non ibridato che forma un SECONDO legame tra i 2 atomi di carbonio.
Un legame singolo o simga ibridato sp3 è libero di ruotare.
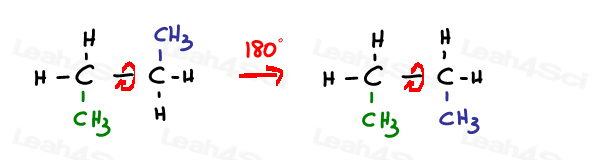
I legami Sp2 pi sono bloccati in posizione.
L’unico modo per ruotare questo legame è rompere il doppio legame, ruotare e riformare il doppio legame, che in genere non viene osservato.
In realtà, questo richiede alta energia, come vedrete nelle vostre reazioni Diels Alder in seguito.,
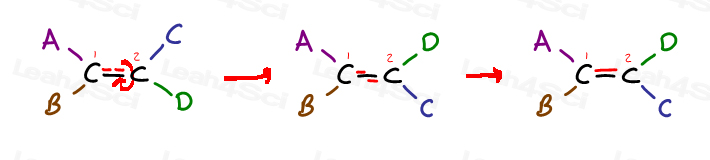
Dai un’occhiata al seguente alchene generico ed è 4 sostituenti:
Il carbonio 1 ha sostituenti A e B; Il carbonio 2 ha sostituenti C e D.
Ma nota specificamente come A sia sullo stesso lato di C e B sia sullo stesso lato di D.
L’unico modo per portare A vicino a D è rompere il legame pi, ruotare la molecola e riformare il legame pi. Altrimenti A è bloccato in posizione vicino a C e B è bloccato in posizione vicino a D.,
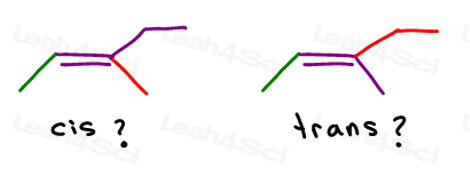
Cis vs Trans Alcheni
Diamo un’occhiata a 2 versioni di 2-butene: il 2-butene è una catena a 4 atomi di carbonio con un doppio legame tra i carboni 2 e 3.
Quindi, possiamo disegnare questo in modo errato, come una molecola lineare:
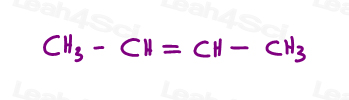
Oppure, disegnare ogni carbonio sp2 con un angolo di legame di 120 gradi. Questo mi dà la possibilità di posizionare entrambi i gruppi metilici su, giù o uno su e uno giù.
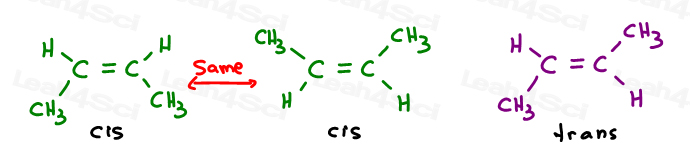
I primi due sono in realtà gli stessi: entrambi cis., Vedete, posso capovolgere la molecola e fare il primo sovrapporre (sovrapporre) il secondo senza rompere alcun legame.
Il terzo è unico. L’unico modo per sovrapporre il terzo è rompere il doppio legame.
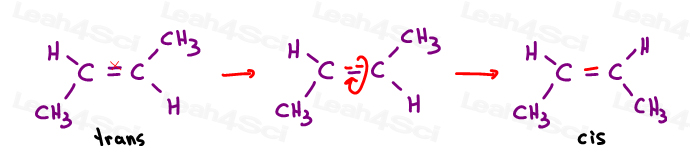
Cis Alcheni
Mi piace pensare di cis come ‘sorelle’. Sono insieme dalla stessa parte.
Cis alcheni hanno sostituenti sullo stesso lato del doppio legame.
Alcheni Trans
Mi piace pensare ai sostituenti trans come se si fossero trasferiti l’uno dall’altro. Mettendoli su lati opposti.,
Gli alcheni trans hanno i loro sostituenti su lati opposti.
Nominare alcheni Cis/Trans:
Una volta identificati gli alcheni cis / trans, nominarli è abbastanza semplice.
1) Per prima cosa, assegna un nome all’alchene usando il tutorial collegato di seguito.
2) Quindi, aggiungi semplicemente ‘cis’ o ‘trans’ davanti al nome.,
Prendi i 2 isomeri geometrici del 2-butene:
I loro nomi propri sono i seguenti:
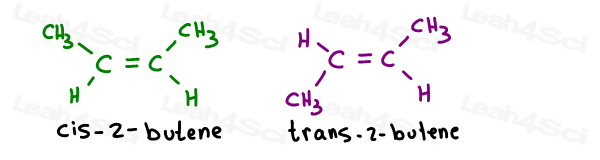
Quando c’è un solo legame pi, non devi specificare quale carbonio è cis o trans da allora. Si capisce da solo.
Quando si ha più di un doppio legame sulla molecola, è necessario specificare quale è cis e quale è trans.,
Prendi questa molecola per esempio: 2,5-ottadiene

Questa molecola ha 2 legami pi. Un cis e un trans.
Poiché esiste più di un legame pi, è necessario specificare quale legame pi è cis e quale è trans.
Stabilità dell’alchene
Non tutti gli isomeri hanno la stessa stabilità.
Si tratta di stabilità – nella chimica organica o nella scienza in generale.

Gli alcheni trans sono PIÙ STABILI delle loro controparti cis.,
Questo è più evidente con sostituenti più grandi.
Alcheni trans
In un alchene trans, i sostituenti sono rivolti l’uno dall’altro.
Essi non ‘ottenere in ogni altri volti’ e quindi, non mente gli altri gruppi.
Cis Alcheni
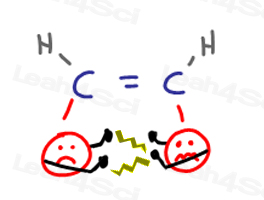 Cis sostituenti alcheni sono vicini tra loro e ‘ottenere in ogni altri volti.’Questo provoca’ argomenti ‘ quando un gruppo invade lo spazio personale dell’altro.
Cis sostituenti alcheni sono vicini tra loro e ‘ottenere in ogni altri volti.’Questo provoca’ argomenti ‘ quando un gruppo invade lo spazio personale dell’altro.
Quando i gruppi cercano di allontanarsi l’uno dall’altro, causano tensione sulla molecola.,
Tutto ciò porta ad una conformazione cis di energia infelice e superiore.
Cis& Trans su composti ciclici
Strutture ad anello o composti ciclici possono anche presentare isomerismo cis / trans senza la presenza di un legame pi.
Ricorda, i sostituenti saranno cis e trans se sono bloccati sul posto. I legami Pi sono un modo per bloccarli in posizione. Gli anelli sono un’altra questione.
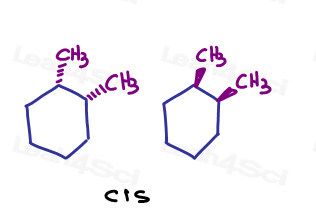
Ad esempio, in 1,2-dimetilcicloesano, posso mostrare entrambi i sostituenti che entrano nella pagina o entrambi che escono dalla pagina.,
Poiché puntano nella stessa direzione, sono cis l’uno all’altro.
Se ne mostro uno che entra nella pagina e uno che esce dalla pagina. Sono trans tra loro.
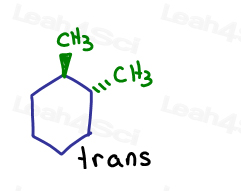
Anche se i carboni sono sp3 e sigma legati tra loro, la molecola stessa non può ruotare a causa della struttura dell’anello. Rinchiuso.
L’unico modo per trasformare il cis-1,2-dimetilcicloesano in trans-1,2-dimetilcicloesano, è quello di aprire l’anello, ruotare e riformare l’anello.,
Cosa succede se c’è più di un sostituente sul carbonio sp2?
Fino ad ora, abbiamo esaminato molecole con un solo sostituente su entrambi i lati del carbonio legato al pi sp2.
Cosa succede se abbiamo un legame pi con 2 atomi o gruppi diversi sul carbonio sp2?
Dai un’occhiata al 3-metil-2-pentene:
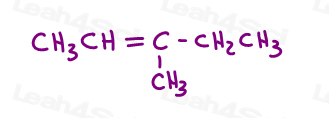
Qui in line structure:
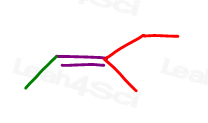
Puoi disegnare questa molecola in 2 modi diversi. Ma paragonerai il metile rosso o l’etile rosso al metile verde quando scegli cis o trans?,
Mentre alcuni professori ti insegneranno a confrontare i gruppi più grandi, la risposta è che NON PUOI confrontare semplicemente sceglierne uno per cis e trans.
Introducendo la notazione Ez
Quando un legame pi ha più di un sostituente su ciascun lato, o contiene sostituenti non carboniosi, avremo bisogno di un sistema più avanzato per identificare l’isomerismo geometrico.
Il sistema E Z richiede la classificazione dei gruppi su entrambi i lati del legame pi., Dobbiamo determinare se i gruppi di priorità più alta sono uno accanto all’altro, Z (pensa cis), o lontani l’uno dall’altro, E (pensa trans).
Ma prima, dobbiamo imparare a classificare i gruppi usando la notazione Cahn-Ingold-Prelog.
Il video qui sotto è dalla mia serie chirality, ma insegna questo concetto in dettaglio. Inizia a guardare da 0: 52
Cahn-Ingold-Prelog in sintesi:
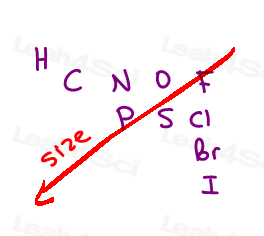
Stiamo classificando gli atomi in base al loro numero atomico.
Non massa del gruppo, non dimensione del gruppo.
Maggiore è il numero atomico dell’atomo direttamente collegato, maggiore è la priorità.,
Here are the 10 most common atoms you’ll come across from high to low priority:
I > Br > Cl > S > P > F > O > N > C > H
Here’s My Simple Approach
- Highlight your double bond, then look at just one half of the molecule at a time., Usa la tua mano o un’altra carta per coprire l’altra metà della molecola.
- Determina quale gruppo ha la priorità più alta e inserisci un numero 1.
Mi piace disegnare una freccia perpendicolare al legame pi in modo da poter vedere chiaramente se è su o giù per confronto.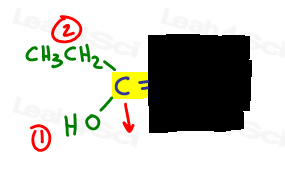
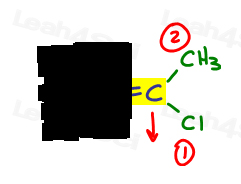
- Fai la stessa cosa per l’altro lato.,
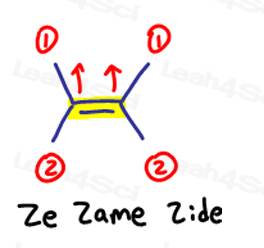
E sta per Eeposite, Z sta per Ze Zame Zide
Se i due gruppi ad alta priorità sono opposti l’uno all’altro, considerali “eeposite” l’uno con l’altro.
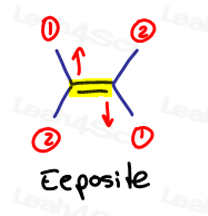 E è per Eeposite.
E è per Eeposite.
Se i due gruppi ad alta priorità sono sullo stesso lato, o dovrei dire su ‘Ze Zame Zide’, sono Z.
Questo vale per le molecole che hanno più di 1 carbonio su entrambi i lati del doppio legame.
Ze Zame Zide.,
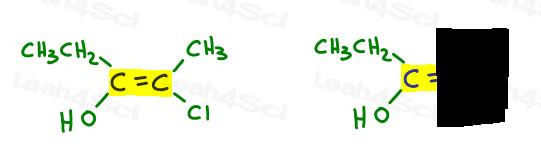
Torniamo all’esempio precedente:
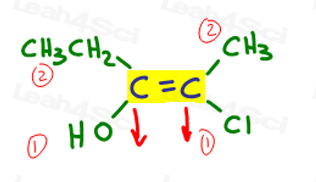
A sinistra, OH supera l’etile poiché l’ossigeno ha un numero atomico più alto rispetto al carbonio. OH è #1 e punti in basso.
A destra, Cl supera il metile poiché il cloro ha un numero atomico più alto rispetto al carbonio. Cl è # 1 e punta verso il basso.
Poiché entrambe le frecce puntano nella stessa direzione (verso il basso), concludiamo che i gruppi di priorità sono su Ze Zame Zide rendendolo Z.,
2 Gruppi di priorità uguali
A volte vedrai una domanda trabocchetto in cui un carbonio sp2 avrà 2 degli stessi identici gruppi.
Poiché non è possibile classificare l’uno sull’altro, non ci sarà isomerismo cis/trans o E / Z.
Ecco 2 esempi comuni:
1) Un legame pi terminale
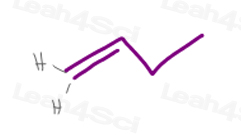
Carbon #1 in 1-il butene ha 2 atomi di idrogeno.
Poiché H vs H hanno la stessa priorità esatta, questa molecola non avrà isomerismo cis/trans o E/Z.,
2) Stessi gruppi esatti sullo stesso carbonio legato al pi sp2.

Il carbonio #2 in 2-metil-2-butene ha 2 gruppi CH3.
Uno sembra essere parte della catena genitore, il secondo sembra essere un sostituente metile.
Tuttavia, quando CH3 viene confrontato con CH3 si classificano esattamente allo stesso modo.
Questa molecola non avrà isomerismo cis/trans n/o E / Z.,
Cis e Trans vs E e Z
Se torniamo ai nostri problemi di pratica cis/trans, come cis e trans 2-butene, vedrai che possiamo usare il sistema E/Z anche qui.
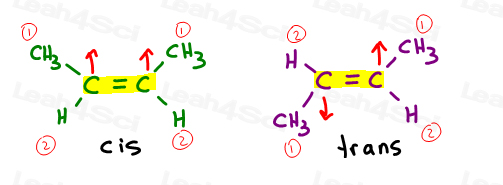
Il carbonio 2 e 3 hanno ciascuno un gruppo metilico superiore a un atomo di idrogeno. Quando sono cis, ottieni Z. Quando sono trans ottieni E.
Una parola di cautela
Puoi usare E/Z per isomeri cis/trans, ma non puoi usare cis/trans per isomeri E / Z complessi come abbiamo già mostrato sopra.,
In sintesi
Gli isomeri Cis vs trans e E vs Z sono isomeri geometrici che si verificano quando i sostituenti sono bloccati in posizione accanto o di fronte all’altro. Questo è visto in entrambi i doppi legami per alcheni e sostituenti su strutture ad anello.
Gli alcheni Cis hanno le stesse dimensioni, gli alcheni trans sono su lati opposti. Quando i sostituenti sono più complicati, utilizzare la notazione E / Z più avanzata dopo aver determinato la relazione dei gruppi ad alta priorità.
Leave a Reply