Acidez Relativa e Valores de pKa
Uma aplicação de Henderson-Hasselbach Equação é a capacidade para determinar a acidez relativa de compostos, por comparação de seus valores de pKa. Quanto mais forte o ácido, maior a ionização, menor o pKa, e menor o pH que o composto produzirá em solução. Alguns valores selecionados de pKa para compostos no estudo da química orgânica são mostrados abaixo., Uma vez que reações orgânicas podem ser realizadas em ambientes não aquosos, o pH pode exceder 14 e compostos orgânicos podem ter valores de pKa acima de 16. É uma variação dessa linha do feiticeiro de Oz, ” Nós não vivemos mais na água.”





é uma idéia muito boa para consolidar a memória aproximada intervalos de pKa dos compostos acima., Uma palavra de precaução: ao usar a tabela pKa, tenha certeza absoluta de que você está considerando o ácido conjugado correto/par base. Se você é convidado a dizer algo sobre a basicidade de amônia (NH3) em comparação com a do íon Etóxido (CH3CH2O-), por exemplo, os valores relevantes de pKa a considerar são 9.2 (o pKa do íon amônio) e 16 (o pKa do etanol). A partir destes números, sabes que o Etóxido é a base mais forte. Não cometa o erro de usar o valor de pKa de 38: Este é o pKa de amônia agindo como um ácido, e diz – lhe o quão básico é o íon NH2 (muito básico!,)
* uma nota sobre o pKa da água: o pKa da água é 14. Textos bioquímicos e químicos orgânicos frequentemente listam o valor como 15.7. Estes textos tiveram incorretamente em conta o valor molar para a concentração de água na constante de equilíbrio. A derivação correta da constante de equilíbrio envolve a atividade da água, que tem um valor de 1.
exemplo
enquanto este curso começa com grupos funcionais únicos, trabalharemos eventualmente com compostos interessantes contendo múltiplos grupos funcionais., Reconhecer quais hidrogênios podem ser ionizados como prótons ácidos e quais hidrogênios não podem, é uma habilidade útil. Observe neste exemplo que precisamos avaliar a acidez potencial em quatro locais diferentes da molécula.
aldeído e protões aromáticos não são de todo ácidos (pKavalues são superiores a 40 – não estão na nossa tabela). Os dois protões no carbono ao lado do carbonilo são ligeiramente ácidos, com valores de pKa em torno de 19-20 de acordo com a tabela., O próton mais ácido está no grupo fenol, então se o composto fosse submetido a um único equivalente molar de base forte, este é o próton que seria doado.
ácido& ambientes Básicos – tudo é relativo na reactividade
porque o nosso objectivo é compreender a reactividade química dinâmica, não precisamos de saber a quantidade específica das formas protonadas e não-relacionadas de um composto. Nós simplesmente precisamos saber qual forma é predominante., Quando o pH do ambiente é menor que o pKa do composto, o ambiente é considerado ácido e o composto existirá predominantemente em sua forma protonada. Quando o pH do ambiente é maior que o pKa do composto, o ambiente é considerado básico e o composto existirá predominantemente em sua forma desprotonada.
Por exemplo, o pKa do ácido acético é de cerca de 5. A um pH de 1, o meio ambiente é considerado ácido e o ácido acético existe predominantemente na sua forma protonada., A pH 8, o ambiente é considerado básico, e o ácido acético torna-se desprotonado para formar acetato (CH3CO2 -). Inversamente, o pKa de fenol é 10. No pH 8, o ambiente é considerado ácido para o fenol e permanece principalmente protonado.
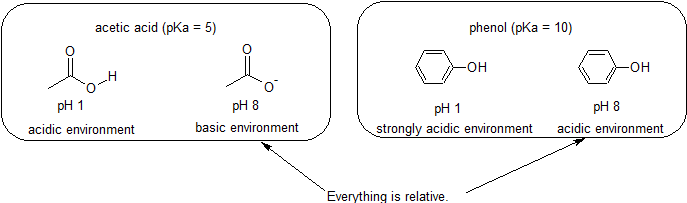
também é importante lembrar que a química orgânica não tem de ocorrer na água, por isso os valores de pKa podem ser até 50.
Exercício
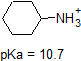
1. Complete a tabela abaixo para indicar se cada composto existe predominantemente na sua forma protonada (ambiente ácido) ou desprotonada (ambiente básico).,
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
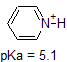 |
|||
 |
|||
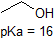 |
|||
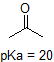 |
Answer 1.,d597″>


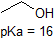



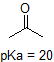



Leave a Reply