cele kształcenia
- Zdefiniuj kwas Arrheniusa.
- podaj przykłady kwasów Arrheniusa.
- opisz jon hydroniowy.
- Zdefiniuj bazę Arrheniusa.
- podaj przykłady baz Arrheniusa.
kwasy Arrheniusa
nie oddychaj zbyt głęboko.
 Wenus jest planetą najbliższą nam, ale ma bardzo inne i nieprzyjazne środowisko.
Wenus jest planetą najbliższą nam, ale ma bardzo inne i nieprzyjazne środowisko.
temperatura powierzchni wynosi średnio około 450°C., Atmosfera składa się z dwutlenku węgla, ale chmury kwasu siarkowego poruszają się przez górną atmosferę, pomagając stworzyć ekstremalnie nieprzyjazne warunki. Z powodu tych warunków Wenus nie jest miejscem, które chcesz odwiedzić na wakacjach.
kwasy Arrheniusa
Szwedzki chemik Svante Arrhenius (1859-1927) jako pierwszy zaproponował teorię wyjaśniającą obserwowane zachowanie kwasów i zasad. Ze względu na ich zdolność do przewodzenia prądu wiedział, że zarówno kwasy, jak i zasady zawierają jony w roztworze., Kwas Arrhenius jest związkiem, który jonizuje, aby uzyskać jony wodorowe (H +) w roztworze wodnym.
kwasy są związkami molekularnymi z jonizowanymi atomami wodoru. Jonizowalne są tylko atomy wodoru wchodzące w skład silnie polarnego wiązania kowalencyjnego. Chlorowodór (HCl) jest gazem w temperaturze pokojowej i pod normalnym ciśnieniem. Wiązanie H-Cl w chlorowodorze jest wiązaniem polarnym. Atom wodoru jest niedoborem elektronów ze względu na wyższą elektroujemność atomu chloru., W związku z tym atom wodoru jest przyciągany do Samotnej pary elektronów w cząsteczce wody, gdy HCl rozpuszcza się w wodzie. W rezultacie Wiązanie H-Cl rozpada się, a oba wiązania elektronów pozostają z Cl, tworząc jon chlorkowy. Jon H + przyłącza się do cząsteczki wody, tworząc jon poliatomowy zwany Jonem hydronium. Jon hydroniowy (H 3 O+) może być uważany za cząsteczkę wody z dołączonym Jonem wodorowym.

Rysunek 1. Powstanie jonu hydroniowego.,
równania pokazujące jonizację kwasu w wodzie są często uproszczone przez pominięcie cząsteczki wody:
![]()
jest to jedynie uproszczenie poprzedniego równania, ale jest ono powszechnie stosowane. Wszelkie jony wodorowe w roztworze wodnym zostaną przyłączone do cząsteczek wody jako jony hydroniowe.
 nie wszystkie atomy wodoru w związkach molekularnych są jonizowalne. W metanie (CH 4) atomy wodoru są kowalencyjnie związane z węglem w wiązaniach, które są tylko nieznacznie polarne., Atomy wodoru nie są zdolne do jonizacji, a metan nie ma właściwości kwaśnych. Kwas octowy (CH 3 COOH) należy do klasy kwasów zwanych kwasami organicznymi. W cząsteczce znajdują się cztery atomy wodoru, ale tylko jeden Wodór związany z atomem tlenu jest jonizowalny.
nie wszystkie atomy wodoru w związkach molekularnych są jonizowalne. W metanie (CH 4) atomy wodoru są kowalencyjnie związane z węglem w wiązaniach, które są tylko nieznacznie polarne., Atomy wodoru nie są zdolne do jonizacji, a metan nie ma właściwości kwaśnych. Kwas octowy (CH 3 COOH) należy do klasy kwasów zwanych kwasami organicznymi. W cząsteczce znajdują się cztery atomy wodoru, ale tylko jeden Wodór związany z atomem tlenu jest jonizowalny.
Wiązanie O-H może być zjonizowane, aby uzyskać jon H + I jon octanowy. Pozostałe atomy wodoru w tej cząsteczce nie są kwaśne.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., Kwas chlorowodorowy i kwas octowy są kwasami monoprotycznymi. Kwas poliprotowy jest kwasem, który zawiera wiele jonizowanych hydrogenów. Najczęściej spotykane kwasy poliprotowe to diprotic (np. H 2 SO 4 ) lub triprotic (np. H 3 PO 4).
bazy Arrheniusa
do czego można to wykorzystać?

wodorotlenek sodu jest wszechstronnym związkiem chemicznym. Może być stosowany do takich przyziemnych celów, jak czyszczenie zatkanych kanalizacji. Kilka preparatów handlowych zawiera wodorotlenek sodu do tego celu. Ma również szereg zastosowań w dziedzinie przetwórstwa spożywczego., Lody zagęszcza się za pomocą NaOH. Jeśli oliwki są namoczone w roztworze zawierającym wodorotlenek sodu i inne chemikalia, oliwki staną się czarne. Miękkie precle są żucia przez zastosowanie wodorotlenku sodu do żywności. Związek ten jest szeroko stosowany w syntezie tworzyw sztucznych, do trawienia aluminium, do usuwania farby i jest stosowany w usuwaniu kończyn bydła(w razie potrzeby).
Zasady Arrheniusa
zasada Arrheniusa jest związkiem, który jonizuje się, dając jony wodorotlenkowe (OH− ) w roztworze wodnym., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., Po rozpuszczeniu w wodzie, każdy dysocjuje do kationu metalu i jonu wodorotlenkowego.
![]()
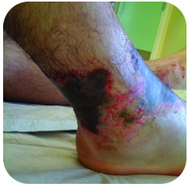
Rysunek 2. Stopa ta ma poważne oparzenia spowodowane długotrwałym kontaktem z roztworem wodorotlenku sodu, znanym również jako ług.
wodorotlenek sodu jest bardzo żrącą substancją znaną również jako ług. Ług jest stosowany jako środek czyszczący i jest składnikiem w produkcji mydeł. Należy zachować ostrożność stosując silne zasady, takie jak wodorotlenek sodu, ponieważ narażenie może prowadzić do poważnych oparzeń (patrz rysunek 2 ).,
sód należy do grupy pierwiastków zwanych metalami alkalicznymi. Roztwór alkaliczny to inna nazwa roztworu podstawowego. Wszystkie metale alkaliczne łatwo reagują z wodą, tworząc wodorotlenek metalu i gaz wodorowy. Uzyskane rozwiązania są podstawowe.
Zasady składające się z kationu metali alkalicznych i anionu wodorotlenkowego są bardzo rozpuszczalne w wodzie. Związki metali z grupy 2 (metale ziem alkalicznych) są również zasadowe. Jednak związki te na ogół nie są tak rozpuszczalne w wodzie., Dlatego reakcje dysocjacji dla tych związków są pokazane jako reakcje równowagi.
te stosunkowo nierozpuszczalne wodorotlenki były niektórymi związkami omawianymi w kontekście stałej produktu rozpuszczalności![]() . Rozpuszczalność wodorotlenku magnezu wynosi 0,0084 g na litr wody w temperaturze 25°C. Ze względu na niską rozpuszczalność wodorotlenek magnezu nie jest tak niebezpieczny jak wodorotlenek sodu., W rzeczywistości wodorotlenek magnezu jest aktywnym składnikiem produktu zwanego mlekiem magnezji, który jest stosowany jako środek zobojętniający lub łagodny środek przeczyszczający.
. Rozpuszczalność wodorotlenku magnezu wynosi 0,0084 g na litr wody w temperaturze 25°C. Ze względu na niską rozpuszczalność wodorotlenek magnezu nie jest tak niebezpieczny jak wodorotlenek sodu., W rzeczywistości wodorotlenek magnezu jest aktywnym składnikiem produktu zwanego mlekiem magnezji, który jest stosowany jako środek zobojętniający lub łagodny środek przeczyszczający.
podsumowanie
- zdefiniowano kwas Arrheniusa.
- podano przykłady kwasów Arrheniusa.
- zdefiniowana jest baza Arrheniusa.
- podano przykłady baz Arrheniusa.
praktyka
przeczytaj materiał pod poniższym linkiem i odpowiedz na następujące pytania:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- jaki był pierwszy pomysł naukowy Arrheniusa?
- co na to jego komisja doktorska?,
- co wygrał za ten pomysł?
- napisz ogólne równanie dysocjacji kwasu Arrheniusa.
przegląd
kwasy Arrheniusa
- co to jest kwas Arrheniusa?
- co to jest Jon hydroniowy?
- czy H2SO4 to kwas monoprotowy czy poliprotowy?
bazy Arrheniusa
- co to jest baza Arrheniusa?
- Jaka jest jedna reakcja, która utworzy bazę Arrheniusa?
- czy zasady alkaliczne są bardzo rozpuszczalne w wodzie?
Leave a Reply