Periodiske trender
for det Første, vi vil fokusere på de enkelte atomer, og tenk på trender knyttet til posisjonen til et element på den periodiske tabellen. Vi vil bruke vårt første modellene som er enkle organiske forbindelser etan, methylamine, og metanol, men konseptet er likt til mer komplekse biomolecules, for eksempel sidekjeder av alanin, lysin, og serin.,
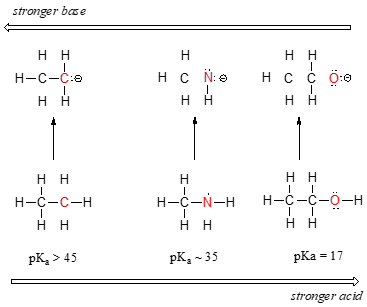
Vi kan se en klar trend i surhet som vi beveger oss fra venstre mot høyre langs andre rad av den periodiske tabellen fra karbon og nitrogen til oksygen. Nøkkelen til å forstå denne trenden er å vurdere den hypotetisk-konjugat base i hvert enkelt tilfelle: mer stabile (svakere) konjugert base, jo sterkere syre. Se på hvor negativt ladet ender opp i hver kobling base., I ethyl anion, den negative ladningen er båret av karbon, mens i methylamine anion og methoxide anion kostnader som er plassert på en nitrogen og oksygen, henholdsvis. Husk periodisk trend i electronegativity: det øker også når vi beveger oss fra venstre mot høyre langs en rad, noe som betyr at oksygen er den mest electronegative av tre og karbon minst. Mer electronegative et atom, jo bedre er det, i stand til å bære en negativ ladning., Dermed methoxide anion er den mest stabile (lavest energi, minst grunnleggende) av de tre konjugat baser, og ethyl anion er den minst stabile (høyeste energi, mest grunnleggende).
Vi kan bruke det samme settet av ideer for å forklare forskjellen i basicity mellom vann og ammoniakk.
Ved å se på pKavalues for den aktuelle konjugat syrer, vi vet at ammoniakk er mer grunnleggende enn vann. Oksygen, som mer electronegative element, holder mer fast til sin enslig par enn nitrogen., Nitrogen enslig par, derfor er mer sannsynlig å bryte ut og danne en ny bond til et proton – det er, med andre ord, mer grunnleggende. Igjen, en mer reaktiv (sterkere) konjugat base betyr mindre reaktive (svakere) konjugat syre.
Når du beveger seg vertikalt i en gitt kolonne i den periodiske tabell, vi igjen observere en klar periodisk trend i surhet. Dette kan best illustreres med halides: basicity, som electronegativity, øker når vi beveger oss opp kolonnen.,

Omvendt, surhet i haloacids øker når vi beveger oss nedover kolonnen.
for å gjøre følelse av denne trenden, vi vil igjen vurdere stabilitet av konjugat baser. Fordi fluor er det mest electronegative halogen element, kan vi forvente fluor å også være den minst grunnleggende halogen-ion. Men faktum er, det er den minst stabile, og de mest grunnleggende! Det viser seg at når man beveger seg vertikalt i den periodiske tabell, størrelsen på atom trumps sin electronegativity med hensyn til basicity., Atomic radius av jod er omtrent det dobbelte av fluor, så i et jod-ion, den negative ladningen er spredt ut over et betydelig større volum:

Dette illustrerer et grunnleggende konsept i organisk kjemi som er viktig nok til å sette i rødt:
Elektrostatiske ladninger, enten positiv eller negativ, er mer stabile når de er ‘spredt’ enn når de er begrenset til ett atom.,
Vi vil se denne ideen uttrykt igjen og igjen gjennom hele studiet av organiske kjemiske, i mange forskjellige sammenhenger. For nå, begrepet brukes bare til påvirkning av atomic radius på anion stabilitet. Fordi fluor er den minst stabile (mest grunnleggende) av halide konjugat baser, HF er minst sure av den haloacids, bare litt sterkere enn eddiksyre. HEI, med en pKa av om -9, er en av de sterkeste syrer kjent.
viktigere er det å studere biologiske organisk kjemi, denne trenden forteller oss at thiols er mer syrlig enn alkohol., Den pKa av thiol gruppe på cystein siden kjeden, for eksempel, er ca 8.3, mens pKa for hydroxl på serin side kjede er på rekkefølgen av 17.
for Å oppsummere: syre styrke øker når vi beveger oss til høyre langs en rad av den periodiske tabell, og så går vi ned i en kolonne.
Draw strukturen av konjugat base som vil danne hvis det sammensatte nedenfor var til å reagere med 1 molar ekvivalent av natriumhydroksid:
Løsning
resonans effekt
I forrige avsnitt vi fokuserer vår oppmerksomhet på periodiske trender – forskjeller i surhet og basicity mellom grupper der utskiftbare proton var bundet til forskjellige elementer., Nå er det på tide å tenke på hvordan strukturen av ulike økologiske grupper bidrar til deres relative surhetsgrad eller basicity, selv når vi snakker om det samme element som fungerer som kalles proton donor/godkjenner. Den første modellen par vi vil vurdere er etanol og eddiksyre, men de konklusjoner vi kommer frem til, vil være like gyldige for alle alkohol og en karboksylsyre grupper.
til Tross for at de er både oksygen syrer, den pKa-verdier av etanol og eddiksyre er svært forskjellige. Hva gjør en karboksylsyre så mye mer syrlig enn alkohol?, Som før, vil vi begynne ved å ta hensyn til kobling baser.
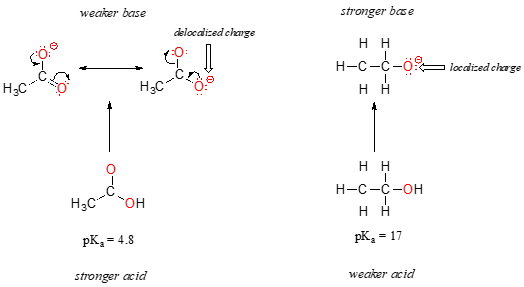
I begge arter, er den negative ladningen på konjugat base er holdt av oksygen, slik periodiske trender ikke kan påberopes. For eddiksyre, men det er en viktig forskjell: en resonans bidragsyter kan bli trukket som negativ ladning er lokalisert på den andre oksygen i gruppen. De to resonans former for kobling base er like i energi, i henhold til våre regler for resonans’., Hva dette betyr, som du kanskje husker, er at den negative ladningen på acetat ion er ikke ligger på en oksygen eller andre: det er heller deles mellom de to. Kjemikere bruker begrepet «delocalization kostnad» for å beskrive denne situasjonen. I ethoxide ion, derimot, er den negative ladningen er «låst» på den ene oksygen – det har noe annet sted å gå.,
Nå er det tid til å tenke tilbake til uttalelse fra den forrige delen som var så viktig at det ble trykt med fet skrift i egne avsnitt – faktisk er det så viktig at vi vil bare si det igjen: «Elektrostatiske ladninger, enten positiv eller negativ, er mer stabile når de er ‘spredt’ enn når de er begrenset til ett atom.»Nå ser vi dette konseptet i en annen sammenheng, der en kostnad blir ‘spredt’ (med andre ord, delocalized) av resonans, snarere enn bare av størrelsen på et atom som er involvert.,
delocalization av kostnad ved resonans har en meget kraftig virkning på reaktivitet av organiske molekyler, nok til å forklare forskjellen på over 12 pKa enheter mellom etanol og eddiksyre (og husk, pKa er en logg-uttrykk, så vi snakker om en forskjell på over 1012 mellom surhet konstanter for de to molekyler). Acetate ion-som er mye mer stabil enn ethoxide ion, all grunn til å virkninger av resonans delocalization.,
resonans effekt også pent forklarer hvorfor et nitrogen atom er grunnleggende når det er i et amin, men ikke grunnleggende når det er en del av en amide gruppe. Husker at i en amide, det er betydelig dobbel-bond tegn til karbon-nitrogen bond, på grunn av en annen resonans bidragsyter der nitrogen enslig par er en del av et p bond.
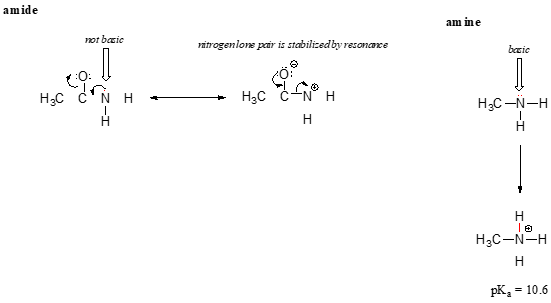
Mens elektronet enslig par av en amine nitrogen er «sittende fast» på ett sted, lone par på en amide nitrogen er delocalized av resonans., Legg merke til at i dette tilfellet, er vi utvider vår sentrale uttalelse å si at electron tetthet – i form av en enslig par – er stabilisert ved resonans delocalization, selv om det er en negativ ladning som er involvert. Her er en annen måte å tenke på det: lone par på en amide nitrogen er ikke tilgjengelig for liming med en proton – disse to elektroner er også «behagelig» å være en del av delocalized pi-bonding system. Lone par på et amin nitrogen, derimot, er ikke en del av en delocalized s system, og er veldig klar for å danne et bånd med noen sure proton som kan være i nærheten.,
Ofte det krever litt forsiktig med tanke på å forutsi den mest sure proton på et molekyl. Ascorbic acid, også kjent som Vitamin C, er en pKa av 4.1.
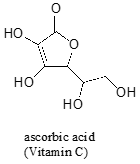
Det er fire hydroksylgrupper på dette molekylet – hvilken er den mest sure? Hvis vi betrakter alle de fire mulige kobling baser, finner vi at det er bare én som vi kan delocalized den negative ladningen over to oksygen atomer.
Rang forbindelser nedenfor fra de fleste syreholdig minst sure, og forklar ditt resonnement.,c3a3fdb788″>
Løsningen
induktiv effekt
Sammenlign pKa-verdier av eddiksyre og dens mono-, di-og tri-klorerte derivater:
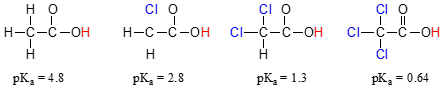
tilstedeværelsen av chlorines klart øker surhetsgraden i karboksylsyre gruppe, men argumentet her ikke har å gjøre med resonans delocalization, fordi ingen ekstra resonans bidragsytere kan bli trukket for klorerte molekyler., Snarere forklaring på dette fenomenet innebærer noe som kalles induktiv effekt. En klor-atomet er mer electronegative enn hydrogen, og dermed er i stand til å «overtale», eller » dra » elektron tetthet mot seg selv, vekk fra kaliumcarboxylaat gruppe. I effekt, klor-atomer er å bidra til å ytterligere spredt ut electron tetthet av konjugat base, som vi vet har en stabiliserende effekt. I denne sammenheng, klor substituent kalles et elektron-uttak gruppe., Legg merke til at pKa-redusere effekten av hver klor atom, mens betydelig, er ikke så dramatisk som delocalizing resonans effekten kan illustreres ved forskjellen i pKa-verdier mellom en alkohol og en karboksylsyre. Generelt, resonans effekter er mer kraftig enn induktiv effekter.
induktiv elektron-uttak av effekt av chlorines skjer gjennom covalent obligasjoner, og dens innflytelse avtar markert med avstand – og dermed en klor to karbonatomer bort fra en karboksylsyre konsernet har en redusert effekt i forhold til en klor bare en karbon unna.
Leave a Reply