El núcleo de un átomo está rodeado por electrones que ocupan conchas, o orbitales de diferentes niveles de energía.
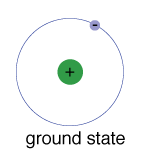
El estado de un electrón, el nivel de energía es normallyoccupies, es el estado de más baja energía para que los electrones.
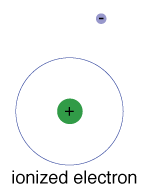
También hay una energía máxima que cada electrón puede tener y seguir siendo parte de su átomo., Más allá de esa energía, el electronis ya no está unido al núcleo del átomo y se considera ionizado.
Cuando un electrón ocupa temporalmente un estado de energía mayor que su estado fundamental, está en un estado excitado. Un electrón puede excitarse si se le da energía extra, como si absorbe un fotón, o paquete, de luz, o choca con un átomo o partícula cercana.
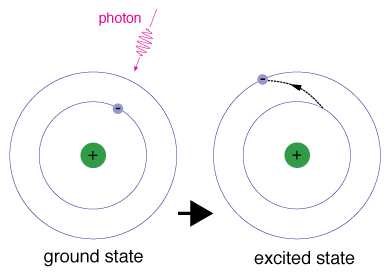
Cada orbital tiene una energía específica asociada con él., Para que un electrón sea impulsado a un orbital con una energía más alta, debe superar la diferencia de energía entre el orbital en el que está, y el bital al que va. Esto significa que debe absorber un fotón que contiene precisamente esa cantidad de energía, o tomar exactamente esa cantidad de energía de otra partícula en una colisión.
Los electrones no permanecen en estados excitados por mucho tiempo – pronto vuelven a sus estados fundamentales, emitiendo un fotón con la misma energía que el que fue absorbido.,

Las transiciones entre los diversos orbitales son únicas para cada elemento porque los niveles de energía están determinados únicamente por los protones y los neutrones en el núcleo. Cuando los electrones de cierto átomo regresan a orbitales inferiores desde estados excitados, los fotones que emiten tienen energías que son características de ese tipo de átomo. Esto da a cada elemento una huella dactilar única, lo que permite identificar los elementos presentes en un contenedor de gas, o incluso una estrella.
Actualizado: noviembre de 2013
Leave a Reply