Periodické trendy
za Prvé, jsme se zaměřit na jednotlivé atomy, a přemýšlet o trendy spojené s postavením prvku v periodické tabulce. Jako naše první modely použijeme jednoduché organické sloučeniny Ethan, methylamin a methanol, ale koncepty se vztahují stejně na složitější biomolekuly, jako jsou boční řetězce alaninu, lysinu a serinu.,
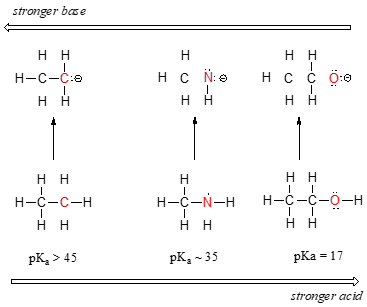
můžeme vidět jasný trend v kyselosti, jak jsme se přesunout zleva doprava podél druhé řady periodické tabulky od uhlíku k dusíku na kyslík. Klíčem k pochopení tohoto trendu je zvážit hypotetickou konjugovanou základnu v každém případě: čím stabilnější (slabší) je konjugovaná báze, tím silnější je kyselina. Podívejte se, kde záporný náboj končí v každé konjugované základně., V ethyl anion, negativní náboj nese uhlíku, zatímco v methylamin anion a methoxide anion poplatky jsou umístěny na dusík a kyslík, resp. Nezapomeňte na periodický trend v elektronegativitě: také se zvyšuje, když se pohybujeme zleva doprava po řadě, což znamená, že kyslík je nejvíce elektronegativní ze tří a uhlík nejméně. Čím více elektronegativního atomu, tím lépe je schopen nést záporný náboj., To znamená, že methoxide anion je nejvíce stabilní (nejnižší energie, nejméně základní) tři konjugované báze, a ethyl anion je nejméně stabilní (nejvyšší energie, základní).
můžeme použít stejnou sadu nápadů k vysvětlení rozdílu v bazicitě mezi vodou a amoniakem.
při pohledu na pKavalues pro příslušné konjugované kyseliny, víme, že amoniak je více základní než voda. Kyslík, jako více elektronegativní prvek, drží těsněji k jeho osamělému páru než dusík., Dusík osamělý pár, proto, je pravděpodobnější, že se odtrhne a vytvoří novou vazbu na proton-to je, jinými slovy, více základní. Opět reaktivnější (silnější) konjugovaná báze znamená méně reaktivní (slabší) konjugovanou kyselinu.
při vertikálním pohybu v daném sloupci periodické tabulky opět pozorujeme jasný periodický trend kyselosti. To je nejlépe ilustrováno halogenidy: bazicita, jako je elektronegativita, se zvyšuje, když se pohybujeme nahoru po sloupci.,

naopak, kyselost v haloacidách se zvyšuje, když se pohybujeme dolů po sloupci.
abychom pochopili tento trend, znovu zvážíme stabilitu konjugovaných základen. Protože fluor je nejvíce elektronegativní halogenový prvek, můžeme očekávat, že fluorid bude také nejméně základním halogenovým iontem. Ale ve skutečnosti je to nejméně stabilní a nejzákladnější! Ukazuje se, že při pohybu svisle v periodické tabulce, velikost atomu trumfy jeho elektronegativita s ohledem na basicity., Atomový poloměr jódu je přibližně dvakrát fluoru, takže v jódu ion, záporný náboj se šíří ven přes výrazně větší objem:

Tohle ilustruje základní koncept v organické chemii, který je dost důležité, aby v červené barvě:
Elektrostatické náboje, zda kladné nebo záporné, jsou více stabilní, když jsou ‚šíří‘, než když jsou omezeny na jeden atom.,
uvidíme tuto myšlenku vyjádřenou znovu a znovu během našeho studia organické reaktivity v mnoha různých kontextech. Prozatím je tento koncept aplikován pouze na vliv atomového poloměru na stabilitu anionu. Protože fluorid je nejméně stabilní (nejzákladnější) halogenidových konjugovaných bází, HF je nejméně kyselá z halokyselin, jen o něco silnější než kyselina octová. Ahoj, s pKa asi -9, je jednou z nejsilnějších známých kyselin.
Ještě důležitější je, aby studium biologické organické chemie, tento trend nám říká, že thioly jsou kyselejší než alkoholy., PKa z thiol skupinu na cysteinu straně řetězce, například, je přibližně 8.3, zatímco pKa pro hydroxl na serinu postranní řetězec je v pořadí 17.
zopakovat: síla kyseliny se zvyšuje, když se pohybujeme doprava podél řady periodické tabulky, a když se pohybujeme dolů po sloupci.
Nakreslete strukturu konjugovaná báze, které by se tvoří, pokud se tato látka dále reagovat s 1 molární ekvivalent hydroxidu sodného:
Řešení
rezonanční efekt
V předchozí části jsme se zaměřili naši pozornost na pravidelných trendů – rozdíly v kyselosti a basicity mezi skupinami, kde vyměnitelný proton byl vázán na různé prvky., Nyní, je čas přemýšlet o tom, jak struktura různých ekologických skupin přispívá k jejich relativní kyselost nebo basicity, i když mluvíme o stejný prvek vystupuje jako protonový donor/akceptor. První model dvojice budeme uvažovat, je ethanol a kyselina octová, ale závěry jsme reach bude stejně platné pro všechny alkohol a karboxylové skupiny.
navzdory skutečnosti, že se jedná o kyslíkové kyseliny, jsou hodnoty pKa ethanolu a kyseliny octové velmi odlišné. Co dělá karboxylovou kyselinu mnohem kyselější než alkohol?, Stejně jako dříve začneme zvažováním konjugovaných základen.
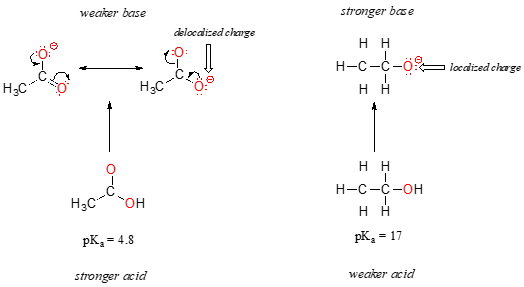
U obou druhů, negativní náboj na konjugovaná báze je v držení kyslíku, takže periodické trendy, nemohou být uplatňovány. U kyseliny octové však existuje klíčový rozdíl: může být nakreslen rezonanční přispěvatel, ve kterém je negativní náboj lokalizován na druhém kyslíku skupiny. Obě rezonanční formy pro konjugovanou základnu mají stejnou energii podle našich „pravidel rezonance“., Co to znamená, Můžete si vzpomenout, je to, že záporný náboj na acetátovém iontu není umístěn na jednom kyslíku nebo na druhém: spíše je sdílen mezi nimi. Chemici používají termín „delokalizace náboje“ k popisu této situace. V ethoxidovém iontu je naopak záporný náboj „uzamčen“ na jediném kyslíku – nemá kam jít.,
Nyní je čas, aby si zpět na toto prohlášení z předchozí části, že bylo tak důležité, že to mám vytištěné tučným písmem v jeho vlastní odstavec – ve skutečnosti, to je tak důležité, že jsme jen řeknu to znovu: „Elektrostatické náboje, zda kladné nebo záporné, jsou více stabilní, když jsou ‚šíří‘, než když jsou omezeny na jeden atom.“Nyní vidíme tento koncept v jiném kontextu, kde je náboj „rozložen“ (jinými slovy delokalizován) rezonancí, spíše než jednoduše velikostí zúčastněného atomu.,
přemístění výroby poplatku do rezonance má velmi silný vliv na reaktivitu organických molekul, dost účet pro rozdíl více než 12 pKa jednotek mezi ethanolu a kyseliny octové (a pamatujte si, že pKa je záznam projevu, takže se bavíme o rozdílu více než 1012 mezi kyselostí konstanty pro dvě molekuly). Acetátový iont je mnohem stabilnější než ethoxidový iont, vše kvůli účinkům resonanční delokalizace.,
rezonanční efekt také pěkně vysvětluje, proč je atom dusíku základní, když je v Aminu, ale není základní, když je součástí amidové skupiny. Připomeňme, že v amidu existuje významná dvojná vazba na vazbu mezi uhlíkem a dusíkem, kvůli druhému rezonančnímu přispěvateli, ve kterém je dusíkový osamělý pár součástí vazby p.
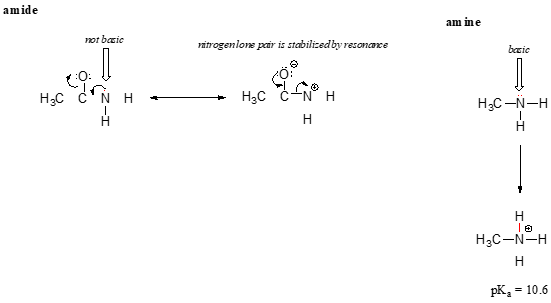
Zatímco elektron elektronové páry amin dusíku je „přilepená“ na jednom místě, osamělý pár na amidový dusík je delokalizována do rezonance., Všimněte si, že v tomto případě, rozšiřujeme naše centrální prohlášení říci, že elektronové hustoty – v podobě lone-pair – je stabilizován rezonancí přemístění výroby, i když tam není negativní náboj podílí. Tady je další způsob, jak myslet na to: lone-pair na amidový dusík není k dispozici pro lepení s proton – tyto dva elektrony jsou příliš „pohodlné“, že část delokalizována pi-bonding systému. Osamělý pár na aminovém dusíku naproti tomu není součástí delokalizovaného p systému a je velmi připraven vytvořit vazbu s jakýmkoli kyselým protonem, který by mohl být poblíž.,
často vyžaduje pečlivou myšlenku předpovědět nejkyslejší proton na molekule. Kyselina askorbová, známá také jako Vitamin C, má pKa 4,1.
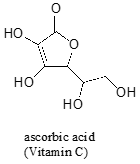
na této molekule jsou čtyři hydroxylové skupiny – která z nich je nejvíce kyselá? Pokud vezmeme v úvahu všechny čtyři možné konjugované báze, zjistíme, že existuje pouze jedna, pro kterou můžeme delokalizovat záporný náboj nad dvěma atomy kyslíku.
řadí sloučeniny níže od většiny kyselých po nejméně kyselé a vysvětluje vaše uvažování.,c3a3fdb788″>
Řešení
indukční efekt
Porovnat hodnoty pKa kyseliny octové kyseliny a jejich mono-, di-a tri-chlorované deriváty:
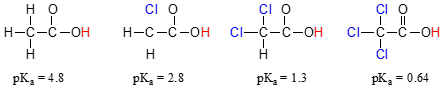
přítomnost chlóry jasně zvyšuje kyselost karboxylové skupiny, ale argument zde nemá co do činění s rezonanční přemístění výroby, protože žádné další rezonance přispěvatelé mohou být vypracovány pro chlorované molekuly., Vysvětlení tohoto jevu spíše zahrnuje něco, co se nazývá induktivní účinek. Atom chloru je více elektronegativní než vodík, a proto je schopen „indukovat“ nebo „vytáhnout“ elektronovou hustotu směrem k sobě, daleko od karboxylátové skupiny. Ve skutečnosti atomy chloru pomáhají dále šířit elektronovou hustotu konjugované báze, která, jak víme, má stabilizační účinek. V této souvislosti se substituent chloru nazývá skupina odebírající elektron., Všimněte si, že pKa-snížení účinku každý atom chloru, zatímco významný, není tak dramatický jako delocalizing rezonanční efekt ilustruje rozdíl v hodnoty pKa mezi alkoholem a karboxylovou kyselinou. Obecně platí, že rezonanční účinky jsou silnější než induktivní účinky.
indukční elektron-ruší účinek chlóry probíhá prostřednictvím kovalentní vazby, a jeho vliv značně snižuje se vzdálenost, tedy chlór dva uhlíky od karboxylové skupiny má nižší účinek ve srovnání s chlorem jen jeden uhlík pryč.
Leave a Reply