Periódico trends
Primeiro, vamos nos concentrar em átomos individuais, e pensar sobre as tendências associadas com a posição de um elemento na tabela periódica. Vamos usar como nossos primeiros modelos os compostos orgânicos simples etano, metilamina e metanol, mas os conceitos se aplicam igualmente a biomoléculas mais complexas, tais como as cadeias laterais de alanina, lisina e serina.,
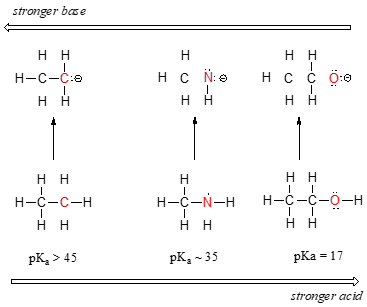
podemos ver uma clara tendência de acidez como nós mover-se da esquerda para a direita ao longo da segunda linha da tabela periódica de carbono nitrogênio oxigênio. A chave para entender esta tendência é considerar a base conjugada hipotética em cada caso: quanto mais estável (mais fraco) a base conjugada, mais forte o ácido. Veja onde a carga negativa acaba em cada base conjugada., No anião etila, a carga negativa é suportada por carbono, enquanto no anião metilamina e anião metoxide as cargas estão localizadas em um nitrogênio e um oxigênio, respectivamente. Lembre – se da tendência periódica na eletronegatividade: ela também aumenta à medida que nos movemos da esquerda para a direita ao longo de uma linha, o que significa que o oxigênio é o mais eletronegativo dos três, e o menos carbono. Quanto mais eletronegativo um átomo, melhor ele é capaz de suportar uma carga negativa., Assim, o anião metoxide é o mais estável (menor energia, menos básico) das três bases conjugadas, e o anião etila é o menos estável (maior energia, mais básico).
Podemos usar o mesmo conjunto de ideias para explicar a diferença na basicidade entre água e amônia.
ao olhar para os pKavalues para os ácidos conjugados apropriados, sabemos que o amoníaco é mais básico do que a água. O oxigênio, como o elemento mais eletronegativo, mantém-se mais firme a seu par solitário do que o nitrogênio., O par solitário de nitrogênio, portanto, é mais provável de quebrar e formar uma nova ligação a um próton – é, em outras palavras, mais básico. Mais uma vez, uma base conjugada mais reativa (mais forte) significa um ácido conjugado menos reativo (mais fraco).
Quando se move verticalmente dentro de uma determinada coluna da tabela periódica, nós novamente observamos uma clara tendência periódica na acidez. Isto é melhor ilustrado com os haletos: a basicidade, como a eletronegatividade, aumenta à medida que subimos a coluna.,

inversamente, a acidez nos haloácidos aumenta à medida que descemos a coluna.
A fim de dar sentido a esta tendência, vamos mais uma vez considerar a estabilidade das bases conjugadas. Como o flúor é o elemento halogénio mais eletronegativo, podemos esperar que o fluoreto seja também o ião halogénio menos básico. Mas, na verdade, é o menos estável, e o mais básico! Acontece que quando se move verticalmente na tabela periódica, o tamanho do átomo supera a sua eletronegatividade em relação à basicidade., O raio atómico de iodo é aproximadamente o dobro do flúor, assim, em uma iodo de íons de lítio, a carga negativa é espalhado em um volume significativamente maior:

Isto ilustra um conceito fundamental em química orgânica que é importante o suficiente para colocar em vermelho:
Electrostática, seja positiva ou negativa, são mais estáveis quando eles estão “espalhados” do que quando eles estão confinados em um átomo.,
veremos esta ideia expressa uma e outra vez ao longo do nosso estudo da reactividade orgânica, em muitos contextos diferentes. Por enquanto, o conceito é aplicado apenas à influência do raio atômico na estabilidade do anião. Como o fluoreto é o menos estável (mais básico) das bases conjugadas de haleto, HF é o menos ácido dos haloácidos, apenas um pouco mais forte do que o ácido acético. HI, com um pKa de cerca de -9, é um dos ácidos mais fortes conhecidos.
Mais importante para o estudo da química orgânica biológica, esta tendência nos diz que os tióis são mais ácidos do que os álcoois., O pKa do grupo tiol na cadeia lateral da cisteína, por exemplo, é de aproximadamente 8,3, enquanto o pKa para o hidroxilo na cadeia lateral da serina é da ordem de 17.
para reiterar: a força do ácido aumenta à medida que nos movemos para a direita ao longo de uma linha da tabela periódica, e à medida que descemos uma coluna.
Desenhar a estrutura do conjugado da base de dados que fariam se o composto a seguir, foram para reagir com 1 molar equivalente de hidróxido de sódio:
Solução
O efeito de ressonância
Na seção anterior, nós focalizamos nossa atenção no periódico trends – se as diferenças de acidez e basicidade entre os grupos, onde os passíveis de troca de prótons foi vinculados a diferentes elementos., Agora, é hora de pensar sobre como a estrutura de diferentes grupos orgânicos contribui para sua acidez relativa ou basicidade, mesmo quando estamos falando do mesmo elemento atuando como o doador/aceitador de prótons. O primeiro par modelo que vamos considerar é etanol e ácido acético, mas as conclusões a que chegamos serão igualmente válidas para todos os grupos de álcool e ácido carboxílico.apesar de serem ambos ácidos oxigenados, os valores de pKa do etanol e do ácido acético são muito diferentes. O que torna um ácido carboxílico muito mais ácido do que um álcool?, Como antes, começamos por considerar as bases conjugadas.
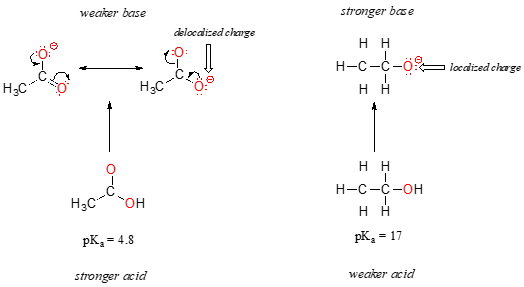
em ambas as espécies, a carga negativa na base conjugada é detida por um oxigénio, pelo que as tendências periódicas não podem ser invocadas. Para o ácido acético, no entanto, há uma diferença fundamental: um contribuidor de ressonância pode ser desenhado em que a carga negativa é localizada no segundo oxigênio do grupo. As duas formas de ressonância para a base conjugada são iguais em energia, de acordo com as nossas “regras de ressonância”., O que isso significa, você pode se lembrar, é que a carga negativa sobre o íon acetato não está localizado em um oxigênio ou outro: pelo contrário, é compartilhada entre os dois. Os químicos utilizam o termo “deslocalização da carga” para descrever esta situação. No íon Etóxido, em contraste, a carga negativa é “travada” no único oxigênio – ele não tem para onde ir.,
Agora é a hora de pensar em voltar para a declaração da seção anterior que era tão importante que ficou impressa em negrito em seu próprio parágrafo – na verdade, ela é tão importante que vamos dizer de novo: “Electrostática, seja positiva ou negativa, são mais estáveis quando eles estão “espalhados” do que quando eles estão confinados em um átomo.”Agora, estamos vendo este conceito em outro contexto, onde uma carga está sendo ‘espalhada’ (em outras palavras, deslocalizada) por ressonância, ao invés de simplesmente pelo tamanho do átomo envolvido.,
O delocalization de carga por ressonância tem um efeito poderoso sobre a reatividade de moléculas orgânicas, suficiente para compensar a diferença de mais de 12 unidades de pKa entre o etanol e o ácido acético (e lembre-se, os valores de pKa é um log de expressão, portanto, estamos falando de uma diferença de mais de 1012 entre as constantes de acidez para as duas moléculas). O íon acetato é muito mais estável do que o íon Etóxido, tudo devido aos efeitos da deslocalização por ressonância.,
o efeito de ressonância também explica muito bem Por que um átomo de nitrogênio é básico quando está em uma amina, mas não básico quando é parte de um grupo amida. Lembre-se que em um amida, há um caráter duplo significativo para a ligação carbono-nitrogênio, devido a um segundo contribuinte de ressonância em que o par solitário de nitrogênio é parte de uma ligação p.
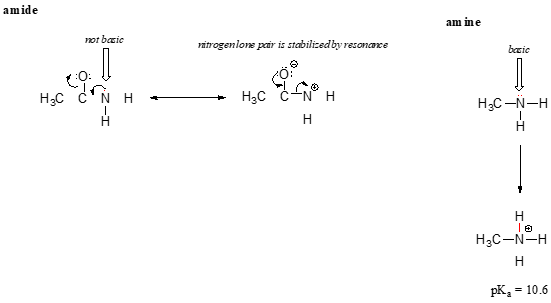
Enquanto o elétron solitário par de uma amina de nitrogênio é ‘preso’ em um só lugar, o par solitário em uma amida de nitrogênio é deslocalizados por ressonância., Note que neste caso, estamos estendendo nossa Declaração central para dizer que a densidade de elétrons – na forma de um par solitário – é estabilizada pela deslocalização por ressonância, mesmo que não haja uma carga negativa envolvida. Aqui está outra maneira de pensar sobre isso: o par solitário em um nitrogênio amido não está disponível para ligação com um próton – estes dois elétrons são muito ‘confortáveis’ sendo parte do sistema de ligação pi deslocalizado. O par solitário em um nitrogênio amino, por contraste, não faz parte de um sistema P deslocalizado, e está muito pronto para formar uma ligação com qualquer próton ácido que possa estar próximo.,
muitas vezes requer algum cuidado para prever o próton mais ácido em uma molécula. O ácido ascórbico, também conhecido como vitamina C, tem um pKa de 4,1.
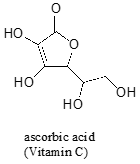
Existem quatro grupos hidroxila nesta molécula – Qual é a mais ácida? Se considerarmos as quatro bases conjugadas possíveis, descobrimos que só há uma para a qual podemos deslocalizar a carga negativa sobre dois átomos de oxigénio.
Rank the compounds below from most acidic to least acidic, and explain your reasoning.,c3a3fdb788″>
Solução:
O efeito indutivo
Compare os valores de pKa do ácido acético e do seu mono-, di-, e tri-cloro derivados:
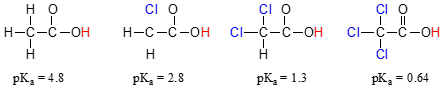
com A presença do o cloro claramente aumenta a acidez do ácido carboxílico grupo, mas a discussão aqui não tem a ver com a ressonância delocalization, porque nenhum adicionais de ressonância de contribuintes pode ser desenhado para as moléculas com cloro., Pelo contrário, a explicação para este fenômeno envolve algo chamado efeito indutivo. Um átomo de cloro é mais eletronegativo do que um hidrogênio, e assim é capaz de ‘induzir’, ou ‘puxar’ a densidade de elétrons para si mesmo, longe do grupo carboxilato. Com efeito, os átomos de cloro estão ajudando a expandir ainda mais a densidade de elétrons da base conjugada, que, como sabemos, tem um efeito estabilizador. Neste contexto, o substituinte de cloro é chamado de grupo de retirada de elétrons., Observe que o efeito de redução de pKa de cada átomo de cloro, embora significativo, não é tão dramático quanto o efeito de ressonância deslocalizante ilustrado pela diferença nos valores de pKa entre um álcool e um ácido carboxílico. Em geral, os efeitos de ressonância são mais poderosos do que os efeitos indutivos.
O efeito indutivo de retirada de elétrons das clorinas ocorre através de ligações covalentes, e sua influência diminui marcadamente com a distância – assim, um cloro a dois carbonos de distância de um grupo de ácido carboxílico tem um efeito diminuído em comparação com um cloro a apenas um carbono de distância.
Leave a Reply