jądro atomu jest otoczone przez elektrony, które zajmują powłoki lub orbitale o różnych poziomach energii.
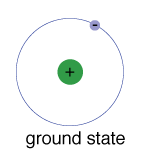
stan uziemienia elektronu, poziom energii, który normalnie zajmuje, jest stanem najniższej energii dla tego elektronu.
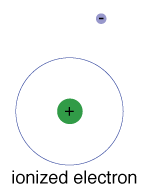
istnieje również maksymalna energia, którą każdy elektron może mieć i nadal być częścią swojego atomu., Poza tą energią elektron nie jest już związany z jądrem atomu i uważa się, że jest zjonizowany.
gdy elektron chwilowo zajmuje stan energetyczny większy od stanu podstawowego, znajduje się w stanie wzbudzonym. Elektron może być wzbudzony, jeśli otrzymuje dodatkową energię, na przykład jeśli pochłania Foton lub pakiet światła lub zderza się z pobliskim atomem lub cząstką.
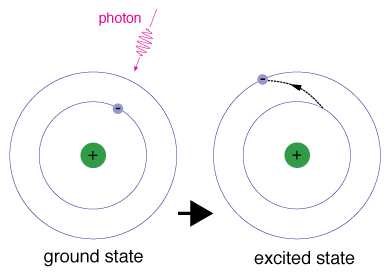
każdy orbital ma określoną energię z nią związaną., Aby anelektron mógł zostać przeniesiony na orbital o wyższej energii, musi on mieć różnicę energii pomiędzy orbitalem, w którym się znajduje, A orbitalem, do którego się zmierza. Oznacza to, że musi absorbować Foton, który zawiera dokładnie taką ilość energii, lub dokładnie taką ilość energii z innej cząstki w zderzeniu.
elektrony nie pozostają w Stanach wzbudzonych przez bardzo długi czas – wkrótce powracają do stanu podłoża, emitując Foton o tej samej energii, co ten, który został zaabsorbowany.,

przejścia między różnymi orbitalami są unikalne dla każdego pierwiastka, ponieważ poziomy energii są jednoznacznie określone przez protony i neutrony w jądrze. Kiedy elektrony pewnego atomu powracają do niższych orbitali ze stanów wzbudzonych, emitowane przez nie fotony mają Energie charakterystyczne dla tego rodzaju atomu. Daje to każdemu elementowi unikalny odcisk palca, umożliwiając identyfikację elementów obecnych w pojemniku z gazem, a nawet w gwieździe.
aktualizacja: listopad 2013
Leave a Reply