względna kwasowość i wartości pKa
zastosowanie równania Hendersona-Hasselbacha polega na możliwości określenia względnej kwasowości związków poprzez porównanie ich wartości pKa. Im silniejszy kwas, tym większa jonizacja, tym niższy pKa i niższe pH związek będzie wytwarzał w roztworze. Poniżej przedstawiono wybrane wartości pKa dla związków w badaniach chemii organicznej., Ponieważ reakcje organiczne mogą być przeprowadzane w środowiskach niewodnych, pH może przekraczać 14, a związki organiczne mogą mieć wartości pKa powyżej 16. Jest to wariacja na temat tego tekstu z Czarnoksiężnika z Krainy Oz: „nie żyjemy już w wodzie.”





bardzo dobrym pomysłem jest zapisanie w pamięci przybliżonych zakresów PKA powyższych związków., Uwaga: Korzystając z tabeli pKa, upewnij się, że rozważasz poprawną parę kwasowo-zasadową. Jeśli zostaniesz poproszony, aby powiedzieć coś o zasadowości amoniaku (NH3) w porównaniu do jonu etoksydowego (CH3CH2O -), na przykład, odpowiednie wartości pKa do rozważenia to 9,2 (PKA jonu amonowego) i 16 (PKA etanolu). Z tych liczb wiadomo, że etoksyd jest silniejszą bazą. Nie popełnij błędu używając wartości PKA 38: jest to PKA amoniaku działającego jako kwas i mówi ci, jak podstawowy jest NH2-jon (bardzo podstawowy!,)
* uwaga na pKa wody: PKA wody wynosi 14. Biochemia i chemia organiczna teksty często wymieniają wartość jako 15.7. Teksty te błędnie uwzględniły wartość molową stężenia wody w stałej równowagi. Prawidłowe wyprowadzenie stałej równowagi obejmuje aktywność wody, która ma wartość 1.
przykład
chociaż ten kurs zaczyna się od pojedynczych grup funkcyjnych, ostatecznie będziemy pracować z interesującymi związkami zawierającymi wiele grup funkcyjnych., Rozpoznawanie, które hydrogeny mogą być zjonizowane jako kwaśne protony, a które hydrogeny nie mogą, jest przydatną umiejętnością. Zauważ w tym przykładzie, że musimy ocenić potencjalną kwasowość w czterech różnych miejscach na cząsteczce.
aldehyd i protony aromatyczne wcale nie są kwaśne (pkawale są powyżej 40 – nie na naszym stole). Dwa protony znajdujące się na węglu obok karbonylu są lekko kwaśne, a wartości pKa według tabeli wynoszą około 19-20., Najbardziej kwaśny proton znajduje się w grupie fenolowej, więc gdyby związek miał być poddany jednemu molowemu odpowiednikowi silnej zasady, To właśnie proton byłby oddawany.
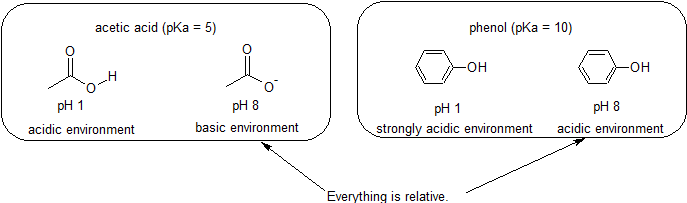
Acidic & Basic Environments-wszystko jest względne pod względem reaktywności
ponieważ naszym celem jest zrozumienie dynamicznej reaktywności chemicznej, nie musimy znać konkretnej ilości protonowanych i nieprotonowanych form związku. Po prostu musimy wiedzieć, która forma jest dominująca., Gdy pH środowiska jest mniejsze niż PKA związku, środowisko jest uważane za kwaśne, a związek będzie występował głównie w postaci protonowanej. Gdy pH środowiska jest większe niż PKA związku, środowisko jest uważane za podstawowe, a związek będzie występował głównie w postaci deprotonowanej.
na przykład pKa kwasu octowego wynosi około 5. Przy pH 1 środowisko jest uważane za kwaśne, a kwas octowy występuje głównie w postaci protonowanej., Przy pH 8 środowisko jest uważane za zasadowe, a kwas octowy ulega deprotonacji, tworząc octan (CH3CO2-). Natomiast pKa fenolu wynosi 10. Przy pH 8 środowisko uważa się za kwaśne dla fenolu i pozostaje przede wszystkim protonowane.
ważne jest również, aby pamiętać, że chemia organiczna nie musi występować w wodzie, więc wartości pKa mogą wynosić nawet 50.
ćwiczenia
1. Należy wypełnić poniższą tabelę, aby wskazać, czy każdy związek występuje głównie w postaci protonowanej (środowisko kwaśne) lub deprotonowanej (środowisko zasadowe).,
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.,d597″>












Leave a Reply