deel uw feedback + open annotaties. Het huidige aantal annotaties op deze pagina wordt berekend.
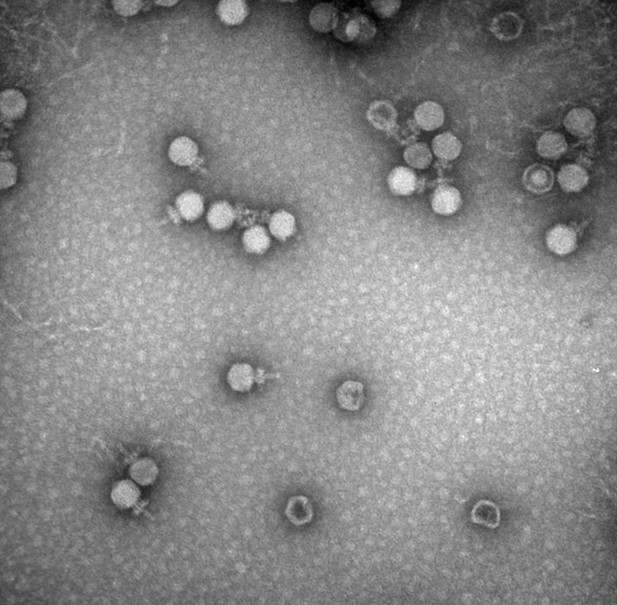
een transmissie-elektronenmicroscopiebeeld van bacteriofagen genomen aan de Universiteit van Alabama ‘ s Optical Analysis Facility. Beeld door: Chou-Zheng en Hatoum-Aslan, 2019 (CC BY 4.,0)
net zoals mensen gevoelig zijn voor virussen, hebben bacteriën hun eigen virussen waarmee ze te kampen hebben. Deze virussen – bekend als Fagen – hechten zich aan de oppervlakte van bacteriële cellen, injecteren hun genetisch materiaal en gebruiken de enzymen van de cellen om zich te vermenigvuldigen terwijl ze hun gastheren vernietigen.
om zich te verdedigen tegen een faagaanval, hebben bacteriën een verscheidenheid aan immuunsystemen ontwikkeld., Bijvoorbeeld, wanneer een bacterie met een immuunsysteem dat als CRISPR-Cas wordt bekend een faag ontmoet, creëert het systeem een ‘geheugen’ van de indringer door een klein fragment van het genetische materiaal van de faag vast te leggen. De stukken van faagdna worden gekopieerd in kleine die molecules CRISPR RNAs worden bekend, die dan met één of meer CAS proteã nen combineren om een groep genoemd Complex Cas te vormen. Dit complex patrouilleert de binnenkant van de cel, draagt het CRISPR RNA voor vergelijking, vergelijkbaar met de manier waarop een detective een vingerafdruk gebruikt om een crimineel te identificeren., Zodra een match is gevonden, hakken De Cas-eiwitten het binnendringende genetische materiaal in stukken en vernietigen de faag.
Er zijn verschillende soorten CRISPR-Cas-systemen. De systemen van Type III zijn onder het wijdst verbreid in aard en zijn uniek in dat zij een bijna ondoordringbare barrière aan Fagen verstrekken die bacteriële cellen proberen te besmetten. De medische onderzoekers onderzoeken het gebruik van fagen als alternatieven voor conventionele antibiotica en zo is het belangrijk om manieren te vinden om deze immune reacties in bacteriën te overwinnen., Echter, het blijft onduidelijk precies hoe Type III CRISPR-Cas systemen in staat zijn om zo ‘ n effectieve verdediging te monteren.
Chou-Zheng en Hatoum-Aslan gebruikten genetische en biochemische benaderingen om het type III CRISPR-Cas-systeem te bestuderen in een bacterie genaamd Staphylococcus epidermidis. De experimenten toonden aan dat twee enzymen genoemd PNPase en RNase J2 cruciale rollen in de defensiereactie speelden die door het systeem wordt teweeggebracht. PNPase hielp om CRISPR RNAs te produceren en beide enzymen werden vereist om te helpen om genetisch materiaal van het binnenvallen van fagen te vernietigen.,eerdere studies hebben aangetoond dat PNPase en RNase J2 deel uitmaken van een machine in bacteriële cellen die gewoonlijk beschadigd genetisch materiaal afbreekt. Daarom tonen deze bevindingen aan dat het type III CRISPR-Cas-systeem in S. epidermidis is geëvolueerd om met een andere weg te coördineren om de bacteriën te helpen aanval van fagen te overleven. CRISPR-Cas het immuunsysteem heeft de basis voor een verscheidenheid van technologieën gevormd die genetica en biomedisch onderzoek blijven revolutioneren., Daarom kan dit werk, samen met het helpen bij het zoeken naar alternatieven voor antibiotica, mogelijk inspireren tot de ontwikkeling van nieuwe genetische technologieën in de toekomst.
Leave a Reply