periodieke trends
eerst zullen we ons richten op individuele atomen en nadenken over trends geassocieerd met de positie van een element op het periodiek systeem. We gebruiken als onze eerste modellen de eenvoudige organische verbindingen ethaan, methylamine en methanol, maar de concepten gelden ook voor meer complexe biomoleculen, zoals de zijketens van alanine, lysine en serine.,
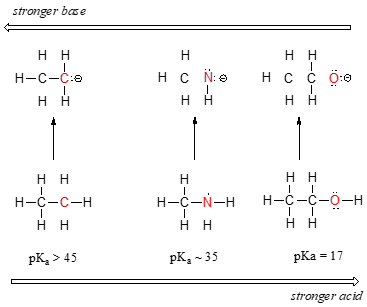
we zien een duidelijke trend in zuurgraad als we van links naar rechts gaan langs de tweede rij van het periodiek systeem van koolstof naar stikstof naar zuurstof. De sleutel tot het begrijpen van deze trend is om de hypothetische geconjugeerde base in elk geval te overwegen: hoe stabieler (zwakker) de geconjugeerde base, hoe sterker het zuur. Kijk waar de negatieve lading eindigt in elke geconjugeerde base., In het ethylanion wordt de negatieve lading gedragen door koolstof, terwijl in het methylamineanion en methoxydeanion de ladingen zich op respectievelijk stikstof en zuurstof bevinden. Denk aan de periodieke trend in elektronegativiteit: het neemt ook toe als we van links naar rechts langs een Rij bewegen, wat betekent dat zuurstof het meest elektronegatief is van de drie, en koolstof het minst. Hoe elektronegatiever een atoom, hoe beter het in staat is om een negatieve lading te dragen., Het methoxide-anion is dus het meest stabiele (laagste energie, minst basisch) van de drie geconjugeerde basen, en het ethyl-anion is het minst stabiel (hoogste energie, meest basisch).
We kunnen dezelfde ideeën gebruiken om het verschil in basiciteit tussen water en ammoniak te verklaren.
door te kijken naar de pKavalues voor de juiste conjugaatzuren, weten we dat ammoniak basischer is dan water. Zuurstof, als het meer elektronegatieve element, houdt strakker aan zijn eenzame paar dan de stikstof., Het stikstof eenzame paar, daarom, is meer kans om te breken en een nieuwe binding aan een proton te vormen-het is, met andere woorden, meer basic. Nogmaals, een meer reactieve (sterkere) geconjugeerde base betekent een minder reactieve (zwakkere) geconjugeerde zuur.
wanneer we verticaal bewegen binnen een bepaalde kolom van het periodiek systeem, zien we opnieuw een duidelijke periodieke trend in zuurgraad. Dit kan het best worden geïllustreerd met de halogeniden: de basiciteit, net als de elektronegativiteit, neemt toe naarmate we de kolom omhoog bewegen.,

omgekeerd neemt de zuurgraad van de halozuren toe naarmate we naar beneden gaan in de kolom.
om deze trend te begrijpen, zullen we opnieuw de stabiliteit van de geconjugeerde basen bekijken. Omdat fluor het meest elektronegatieve halogeenelement is, kunnen we verwachten dat fluoride ook het minst basische halogeenion is. Maar in feite is het de minst stabiele, en de meest basale! Het blijkt dat bij het verticaal bewegen in het periodiek systeem, de grootte van het atoom zijn elektronegativiteit overtroeft ten opzichte van basiciteit., De atoomstraal van jodium is ongeveer het dubbele van die van fluor, dus in een jodium-ion, de negatieve lading wordt verdeeld over een groter volume:

Dit illustreert een belangrijk concept in de organische chemie, dat is belangrijk genoeg om in het rood:
Elektrostatische ladingen (positief of negatief, zijn stabiel wanneer ze worden ‘verdeeld’ dan wanneer ze worden beperkt tot één atoom.,
we zullen dit idee steeds weer tot uitdrukking zien komen in onze studie van organische reactiviteit, in veel verschillende contexten. Op dit moment wordt het concept alleen toegepast op de invloed van atomaire straal op anionstabiliteit. Omdat fluoride de minst stabiele (meest basische) van de halozuurbasen is, is HF de minst zure van de halozuren, slechts iets sterker dan azijnzuur. HI, met een pKa van ongeveer -9, is een van de sterkste bekende zuren.
belangrijker voor de studie van de biologische organische chemie, vertelt deze trend ons dat thiolen zuurder zijn dan alcoholen., De pKa van de thiolgroep aan de zijketen van de cysteïne is bijvoorbeeld ongeveer 8,3, terwijl de pKa voor de hydroxl aan de zijketen van de serine ongeveer 17 is.
om te herhalen: de zuursterkte neemt toe als we naar rechts bewegen langs een rij van het periodiek systeem, en als we naar beneden bewegen een kolom.
Teken de structuur van de geconjugeerde base zou vormen als de samengestelde hieronder waren om te reageren met 1 molair equivalent van sodium hydroxide:
Oplossing
Het resonantie-effect
In de vorige paragraaf hebben we ons gericht op periodieke trends – de verschillen in zuurgraad en basicity tussen de groepen waar de verwisselbare proton is gebonden aan verschillende elementen., Nu is het tijd om na te denken over hoe de structuur van verschillende organische groepen bijdraagt aan hun relatieve zuurgraad of basiciteit, zelfs als we het hebben over hetzelfde element dat fungeert als de Proton donor/acceptor. Het eerste modelpaar dat we zullen overwegen is ethanol en azijnzuur, maar de conclusies die we zullen bereiken zullen even geldig zijn voor alle alcohol-en carboxylzuurgroepen.
ondanks het feit dat het beide zuurstofzuren zijn, zijn de pKa-waarden van ethanol en azijnzuur zeer verschillend. Wat maakt een carbonzuur zoveel zuurder dan een alcohol?, Zoals voorheen, beginnen we met het overwegen van de geconjugeerde basen.
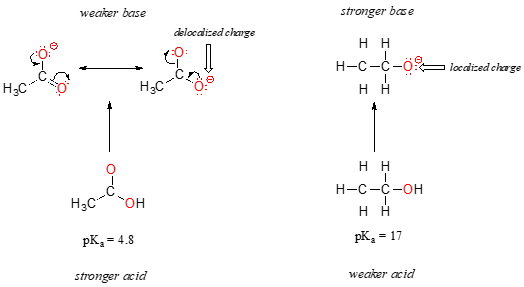
bij beide soorten wordt de negatieve lading op de geconjugeerde base vastgehouden door een zuurstof, zodat periodieke trends niet kunnen worden aangeroepen. Voor azijnzuur, echter, is er een belangrijk verschil: een resonantie bijdrager kan worden getrokken waarin de negatieve lading is gelokaliseerd op de tweede zuurstof van de groep. De twee resonantievormen voor de geconjugeerde base zijn gelijk in energie, volgens onze ‘resonantieregels’., Wat dit betekent, herinnert u zich misschien, is dat de negatieve lading op het acetaat-ion zich niet op de ene zuurstof of de andere bevindt: eerder wordt het gedeeld tussen de twee. Chemici gebruiken de term ‘delokalisatie van lading’ om deze situatie te beschrijven. In het ethoxyde-ion daarentegen is de negatieve lading ‘vergrendeld’ op de enkele zuurstof – het kan nergens anders heen.,
nu is het tijd om terug te denken aan die uitspraak uit de vorige paragraaf die zo belangrijk was dat het in vet gedrukt werd in zijn eigen paragraaf – in feite is het zo belangrijk dat we het nogmaals zullen zeggen: “elektrostatische ladingen, positief of negatief, zijn stabieler wanneer ze ‘verspreid’ zijn dan wanneer ze beperkt zijn tot één atoom.”Nu zien we dit concept in een andere context, waar een lading wordt ‘verspreid’ (met andere woorden, gedelokaliseerd) door resonantie, in plaats van gewoon door de grootte van het betrokken atoom.,
De delokalisatie van lading door resonantie heeft een zeer krachtig effect op de reactiviteit van organische moleculen, genoeg om rekening te houden met het verschil van meer dan 12 PKA eenheden tussen ethanol en azijnzuur (en vergeet niet, pKa is een log expressie, dus we hebben het over een verschil van meer dan 1012 tussen de zuurheidsconstanten voor de twee moleculen). Het acetaation is zo veel stabieler dan het ethoxideion, allemaal door de effecten van resonantiedelokalisatie.,
het resonantie-effect verklaart ook mooi waarom een stikstofatoom basisch is als het zich in een amine bevindt, maar niet basisch als het deel uitmaakt van een amidegroep. Bedenk dat er in een amide een significant dubbelbindingskarakter is aan de koolstof-stikstofbinding, als gevolg van een tweede resonantiebijdrager waarbij het stikstof-eenzame paar deel uitmaakt van een p-binding.
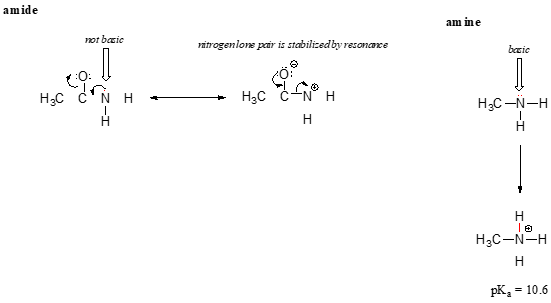
terwijl het elektron eenzame paar van een aminestikstof op één plaats ‘vastzit’, wordt het eenzame paar op een amidestikstof gedelokaliseerd door resonantie., Merk op dat we in dit geval onze centrale stelling uitbreiden om te zeggen dat elektronendichtheid – in de vorm van een eenzaam paar – wordt gestabiliseerd door resonantie delokalisatie, ook al is er geen negatieve lading bij betrokken. Hier is een andere manier om erover na te denken: het eenzame paar op een amidestikstof is niet beschikbaar voor binding met een proton – deze twee elektronen zijn te ‘comfortabel’ om deel uit te maken van het gedelokaliseerde pi-bindingssysteem. Het eenzame paar op een aminestikstof, daarentegen, maakt geen deel uit van een gedelokaliseerd p-systeem, en is zeer klaar om een band te vormen met elk zuur proton dat in de buurt zou kunnen zijn.,
vaak is het nodig om zorgvuldig na te denken over het meest zure proton op een molecuul. Ascorbinezuur, ook bekend als vitamine C, heeft een pKa van 4,1.
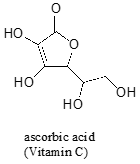
Er zijn vier hydroxylgroepen op dit molecuul – welke is het meest zuur? Als we alle vier de mogelijke geconjugeerde basen bekijken, zien we dat er maar één is waarvoor we de negatieve lading over twee zuurstofatomen kunnen delokaliseren.
Rangschik de verbindingen hieronder van meest zure naar minst zure, en leg uw redenering uit.,c3a3fdb788″>
Oplossing
Het inductieve effect
Vergelijk de pKa waarden van azijnzuur en de mono-, di-en tri-chloorderivaten:
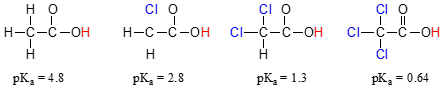
De aanwezigheid van de chlorines duidelijk verhoogt de zuurgraad van de carboxylic zure groep, maar het argument hier niet te maken hebben met resonantie delocalisatie, omdat er geen extra resonantie medewerkers kunnen worden getrokken voor de gechloreerde moleculen., Integendeel, de verklaring voor dit fenomeen impliceert iets dat het inductieve effect wordt genoemd. Een chlooratoom is elektronegatiever dan een waterstof, en is dus in staat om elektronendichtheid naar zich toe te ‘induceren’, of ‘trekken’ van de carboxylaatgroep. In feite helpen de chlooratomen de elektronendichtheid van de geconjugeerde base verder uit te spreiden, wat zoals we weten een stabiliserend effect heeft. In deze context wordt de chloorsubstituent een elektron-terugtrekkende groep genoemd., Merk op dat het PKA-verlagende effect van elk chlooratoom, hoewel significant, niet zo dramatisch is als het delocaliserende resonantie-effect dat wordt geïllustreerd door het verschil in PKA-waarden tussen een alcohol en een carboxylzuur. In het algemeen zijn resonantie-effecten krachtiger dan inductieve effecten.
het inductieve elektron-terugtrekkende effect van de chlorines vindt plaats door covalente bindingen, en de invloed ervan neemt sterk af met afstand – zo heeft een chloor twee koolstofatomen verwijderd van een carboxylzuurgroep een verminderd effect in vergelijking met een chloor slechts één koolstofatoom verwijderd.
Leave a Reply