Relative Surhetsgrad og pKa-Verdier
En anvendelse av Henderson-Hasselbach Ligningen er muligheten til å bestemme den relative surhetsgrad av forbindelser ved å sammenligne deres pKa-verdier. Jo sterkere en syre, jo større ionisering, jo lavere pKa, og jo lavere pH-forbindelsen vil produsere i løsningen. Noen valgte pKa-verdier for forbindelser i studiet av organiske kjemi er vist nedenfor., Siden organiske reaksjoner kan utføres i ikke-vandige omgivelser, pH kan overstige 14 og organiske forbindelser kan ha pKa-verdier over 16. Det er en variasjon på at linje fra the Wizard of Oz, «Vi trenger ikke leve i vann lenger.»





Det er en veldig god idé å forplikte seg til å minne omtrentlig pKa områder av forbindelser over., Et ord av advarsel: når du bruker pKa bord, være helt sikker på at du vurderer riktig kobling syre/base-par. Hvis du blir bedt om å si noe om basicity av ammoniakk (NH3) sammenlignet med ethoxide ion (CH3CH2O-), for eksempel, er det relevante pKa-verdier for å vurdere 9.2 (den pKa av ammonium-ion) og 16 (den pKa av etanol). Fra disse tallene, vet du at ethoxide er sterkere base. Ikke gjør den feilen å bruke pKa-verdi på 38: dette er pKa av ammoniakk opptrer som en syre, og forteller deg hvordan grunnleggende NH2 – ion-er (svært grunnleggende!,)
* Et notat på pKa av vann: pKa av vann er 14. Biokjemi og organisk kjemi tekster ofte listen verdien som 15.7. Disse tekstene har feil priset den molar verdi for konsentrasjonen av vann i likevekt konstant. Riktig avledning av likevekt konstant innebærer aktivitet av vann, som har en verdi på 1.
Eksempel
Mens dette kurset begynner med enkle funksjonelle grupper, vil vi til slutt jobbe med interessante forbindelser som inneholder flere funksjonelle grupper., Gjenkjenne som hydrogens kan bli ionisert som sure protoner og som hydrogens kan IKKE, er en nyttig ferdighet. Legg merke til i dette eksempelet er det vi trenger for å vurdere potensialet surhet på fire forskjellige steder på molekylet.
Aldehyd og aromatiske protoner er ikke i det hele tatt sure (pKavalues er over 40 – ikke på bordet). De to protoner på karbon neste til karbonyl er litt syrlig, med pKa-verdier rundt 19-20 i henhold til tabellen., Den mest sure proton er på fenol gruppe, så hvis det sammensatte var å bli utsatt for en enkelt molar ekvivalent av sterk base, dette er proton som ville bli donert.
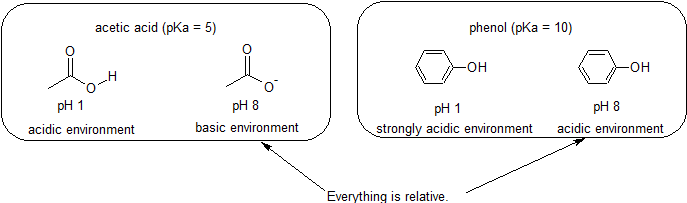
Sure & Grunnleggende Miljøer – Alt er Relativt i Reaktivitet
Fordi vårt mål er å forstå dynamiske kjemisk reaktivitet, vi trenger IKKE å vite det spesifikke beløpet på protonated og unprotonated former av et sammensatt. Vi trenger bare å vite hvilket skjema som dominerer., Når pH i miljøet er mindre enn pKa av det sammensatte, miljø regnes som sure og sammensatte at det vil være overveiende i sin protonated form. Når pH i miljøet er større enn pKa av det sammensatte, miljø regnes som grunnleggende og sammensatte at det vil være overveiende i sin deprotonated form.
For eksempel, pKa av eddiksyre er om 5. Ved en pH-verdi på 1, miljø regnes som sure og eddiksyre finnes hovedsakelig i sin protonated form., Ved pH 8, miljø regnes som grunnleggende, og eddiksyre blir deprotonated å danne acetat (CH3CO2-). Derimot er pKa av fenol er 10. Ved pH 8, miljøet er vurdert sure for fenol og det er fortsatt først og fremst protonated.
Det er også viktig å huske på at organisk kjemi IKKE er nødt til å forekomme i vann så pKa-verdiene kan være så høyt som 50.
Trening
1. Komplett tabellen nedenfor for å angi om hvert stoff som finnes hovedsakelig i sin protonated (sure miljø) eller deprotonated (grunnleggende miljø) form.,
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.,d597″>












Leave a Reply