időszakos tendenciák
először az egyes atomokra összpontosítunk, és gondolkodunk az elem helyzetével kapcsolatos tendenciákról a periódusos rendszerben. Első modellként az egyszerű szerves vegyületeket, az etánt, a metilamint és a metanolt használjuk, de a fogalmak egyformán vonatkoznak a bonyolultabb biomolekulákra, mint például az alanin, a lizin és a szerin oldalláncai.,
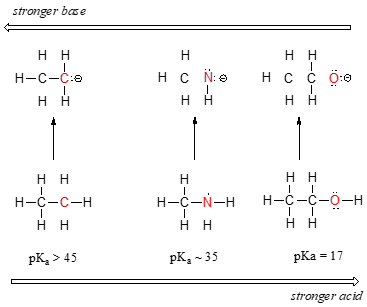
a savasság egyértelmű tendenciáját láthatjuk, amikor balról jobbra haladunk a periódusos rendszer második sora mentén a széntől a nitrogénig az oxigénig. Ennek a tendenciának a megértése a legfontosabb, hogy minden esetben figyelembe vesszük a hipotetikus konjugált bázist: minél stabilabb (gyengébb) a konjugált bázis, annál erősebb a sav. Nézd meg, hol végződik a negatív töltés minden konjugált bázisban., Az etil-anionban a negatív töltést a szén viseli, míg a metilamin-anionban és a metoxid-anionban a töltések nitrogénen, illetve oxigénen helyezkednek el. Ne feledje az elektronegativitás időszakos tendenciáját: ez is növekszik, amikor balról jobbra haladunk egy sor mentén, ami azt jelenti, hogy az oxigén a három legelektronegatívabb, a szén pedig a legkevésbé. Minél több elektronegatív atom, annál jobb negatív töltést képes viselni., Így a metoxid anion a három konjugált bázis legstabilabb (legalacsonyabb energiájú, legkevésbé bázikus), az etil-anion pedig a legkevésbé stabil (legmagasabb energia, legalapvetőbb).
ugyanazokat az ötleteket használhatjuk, hogy megmagyarázzuk a víz és az ammónia közötti bázikusság különbségét.
a megfelelő konjugált savak pKavalues-ját vizsgálva tudjuk, hogy az ammónia bázikusabb, mint a víz. Az oxigén, mint az elektronegatívabb elem, szorosabban tartja a magányos párját, mint a nitrogén., A nitrogén magányos pár tehát nagyobb valószínűséggel szakad el, és új kötést képez egy protonhoz – ez, más szóval, alaposabb. Ismét egy reaktív (erősebb) konjugált bázis kevésbé reaktív (gyengébb) konjugált savat jelent.
ha függőlegesen mozog a Periódusos táblázat egy adott oszlopán belül, ismét megfigyeljük a savasság egyértelmű időszakos tendenciáját. Ezt legjobban a halogenidekkel lehet szemléltetni: a bázikusság, mint az elektronegativitás, növekszik, amikor felfelé haladunk az oszlopon.,

fordítva, a haloacidák savassága növekszik, ahogy lefelé haladunk az oszlopon.
annak érdekében, hogy megértsük ezt a tendenciát, ismét megvizsgáljuk a konjugált bázisok stabilitását. Mivel a fluor a legelektronegatívabb halogén elem, számíthatunk arra, hogy a fluorid is a legkevésbé alapvető halogén ion. De valójában ez a legkevésbé stabil, a legalapvetőbb! Kiderül, hogy ha függőlegesen mozog a periódusos rendszerben, az atom mérete a bázikusság tekintetében csökkenti elektronegativitását., Az atom sugara a jód körülbelül kétszer, hogy a fluor, így a jód-ion, a negatív töltés terjed ki, mint egy jelentősen nagyobb mennyiség:

Ez azt mutatja, hogy egy alapvető koncepció szerves kémia, ami elég fontos ahhoz, hogy piros:
Elektrosztatikus feltöltődés, akár pozitív, akár negatív, vagy stabilabb, amikor ‘szét, mint amikor csak az egyik atom.,
ezt az elképzelést újra és újra kifejezzük a szerves reaktivitás tanulmányozása során, sok különböző kontextusban. Jelenleg a koncepciót csak az atomi sugárnak az anion stabilitására gyakorolt hatására alkalmazzák. Mivel a fluorid a Halid konjugált bázisok legkevésbé stabil (legalapvetőbb), a HF a haloacidok legkevésbé savas, csak kissé erősebb, mint az ecetsav. Szia, egy pKa körülbelül -9, az egyik legerősebb sav ismert.
ami még fontosabb a biológiai Szerves Kémia tanulmányozásához, ez a tendencia azt mondja nekünk, hogy a tiolok savasabbak, mint az alkoholok., A cisztein oldallánc tiolcsoportjának pKa-ja például körülbelül 8,3, míg a szerin oldalláncon lévő hidroxl PKA-ja 17.
megismétlem: a sav erőssége növekszik, ahogy jobbra haladunk a periódusos rendszer egy sora mentén, miközben lefelé haladunk egy oszlopon.
Felhívni a szerkezet a konjugált bázis hogy képezné, ha a vegyület alatt volt reagálni, 1 moláris egyenértékű a nátrium-hidroxid:
Megoldás
A rezonancia hatás
az előző részben mi elsősorban a figyelmet a rendszeres tendenciákat – a különbségek savasságát basicity csoportok között, ahol a cserélhető proton várható volt, hogy a különböző elemeket., Most itt az ideje gondolkodni arról, hogy a különböző szerves csoportok szerkezete hogyan járul hozzá relatív savasságukhoz vagy bázikusságukhoz, még akkor is, ha ugyanazon elemről beszélünk, mint a proton donor/akceptor. Az első modellpár, amelyet figyelembe veszünk, az etanol és az ecetsav, de az általunk levont következtetések minden alkohol-és karbonsavcsoportra egyformán érvényesek lesznek.
annak ellenére, hogy mindkettő oxigénsav, az etanol és az ecetsav pKa-értéke nagyon eltérő. Mi teszi a karbonsavat sokkal savasabbá, mint egy alkoholt?, Mint korábban, a konjugált bázisok figyelembevételével kezdjük.
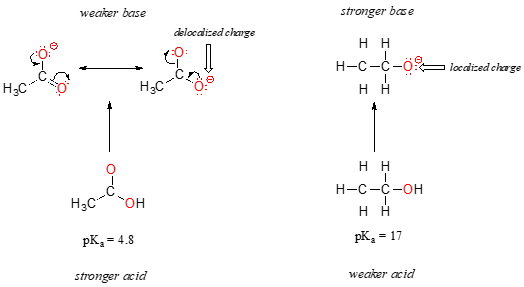
mindkét faj esetében a konjugált bázis negatív töltését oxigén tartja, így az időszakos tendenciákat nem lehet hivatkozni. Az ecetsav esetében azonban kulcsfontosságú különbség van: egy rezonancia-közreműködő húzható, amelyben a negatív töltés a csoport második oxigénjére lokalizálódik. A konjugált bázis két rezonanciaformája energiában egyenlő, a “rezonancia szabályai” szerint., Ez azt jelenti, hogy emlékeztethet arra, hogy az acetát-ion negatív töltése nem az egyik oxigénen vagy a másikon található: inkább a kettő között oszlik meg. A vegyészek a “töltés delokalizációja” kifejezést használják a helyzet leírására. Az etoxidionban ezzel szemben a negatív töltés “le van zárva” az egyetlen oxigénre – nincs hová mennie.,
Most van itt az ideje, hogy gondoljunk vissza, hogy a nyilatkozatot az előző fejezetből, hogy volt olyan fontos, hogy megjelent a félkövér saját bekezdés – tény, hogy ez olyan fontos, hogy majd azt mondjuk újra: “Elektrosztatikus feltöltődés, akár pozitív, akár negatív, vagy stabilabb, amikor ‘szét, mint amikor csak az egyik atom.”Most ezt a koncepciót egy másik kontextusban látjuk, ahol egy töltést rezonancia “szétterít” (más szóval delokalizál), nem pedig egyszerűen az érintett atom mérete.,
A delocalization a díjat a rezonancia van egy nagyon erőteljes hatása van a reaktivitás, szerves molekulák, ahhoz, hogy figyelembe a különbség több mint 12 pKa egységek között, etanol vagy az ecetsav (ne feledd, pKa egy napló kifejezés, így beszélünk a különbség több mint 1012 között a savas állandók a két molekula). Az acetát-ion sokkal stabilabb, mint az etoxid-ion, mindezt a rezonancia delokalizáció hatásai miatt.,
a rezonancia hatás szépen megmagyarázza, hogy miért alapvető a nitrogénatom, ha egy aminban van, de nem alapvető, ha egy amidcsoport része. Emlékezzünk vissza, hogy egy amidban a szén-nitrogén kötésnek jelentős kettős kötési karaktere van, egy második rezonancia-közreműködő miatt, amelyben a nitrogén magányos pár egy P kötés része.
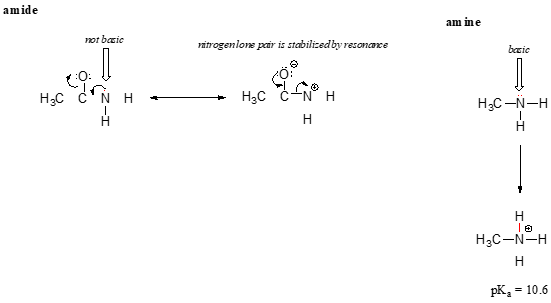
míg az amin nitrogén elektronpárja “beragadt” egy helyen, az amid nitrogénen lévő magányos pár rezonanciával van elválasztva., Figyeljük meg, hogy ebben az esetben kiterjesztjük központi nyilatkozatunkat, hogy azt mondjuk, hogy az elektronsűrűséget – magányos pár formájában – rezonancia delokalizációval stabilizáljuk, annak ellenére, hogy nincs negatív töltés. Itt van egy másik módja annak, hogy gondolj bele: a magányos pár egy amid nitrogén nem áll rendelkezésre, a kötés egy proton – e két elektron is ‘kényelmes’, hogy része a delocalized pi-kötés rendszer. Ezzel szemben az amin nitrogénben lévő magányos pár nem része a delokalizált p rendszernek, és nagyon készen áll arra, hogy kötést alakítson ki a közelben lévő savas protonnal.,
gyakran gondos gondolkodást igényel, hogy megjósolja a molekula savasabb protonját. Az aszkorbinsav, más néven C-Vitamin, 4,1 pKa-val rendelkezik.
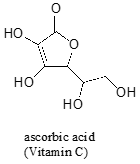
négy hidroxilcsoport van ezen a molekulán – melyik a leginkább savas? Ha mind a négy lehetséges konjugált bázist figyelembe vesszük, azt találjuk, hogy csak egy van, amelyre a negatív töltést két oxigénatom felett el tudjuk helyezni.
rangsorolja az alábbi vegyületeket a savasabbról a legkevésbé savasra, és magyarázza el érvelését.,c3a3fdb788″>
Megoldás
Az induktív hatás
Hasonlítsa össze a pKa értékei ecetsav, valamint a mono-, di-, illetve tri-klórozott származékok:
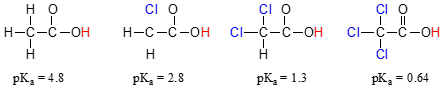
a jelenléte A chlorines egyértelműen növeli a savasság a karbonsav-csoport, de az az érv, itt nem kell a rezonancia delocalization, mert nincs további rezonancia közreműködők lehet levonni a klórozott molekulák., Inkább ennek a jelenségnek a magyarázata magában foglalja az induktív hatást. A klóratom elektronegatívabb, mint a hidrogén, így képes “indukálni”, vagy “húzni” az elektronsűrűséget maga felé, távol a karboxilát csoporttól. Valójában a klóratomok segítenek tovább terjeszteni a konjugált bázis elektronsűrűségét, amely, mint tudjuk, stabilizáló hatást fejt ki. Ebben az összefüggésben a klór-szubsztituenst elektron-kivonó csoportnak nevezik., Figyeljük meg, hogy az egyes klóratomok pKa-csökkentő hatása, bár jelentős, nem olyan drámai, mint a delokalizáló rezonancia hatás, amelyet az alkohol és a karbonsav közötti pKa-értékek különbsége szemléltet. Általában a rezonancia hatások erősebbek, mint az induktív hatások.
Az induktív elektron-visszavonja hatása a chlorines keresztül zajlik, kovalens kötés, illetve annak hatása jelentősen csökken a távolság, így a klór a két szénatom el a karbonsav-csoport csökkent hatása, összehasonlítva a klór csak egy szén-dioxid-el.
Leave a Reply