Periodic trends
primero, nos centraremos en átomos individuales, y pensaremos en las tendencias asociadas con la posición de un elemento en la Tabla periódica. Usaremos como nuestros primeros modelos los compuestos orgánicos simples etano, metilamina y metanol, pero los conceptos se aplican igualmente a biomoléculas más complejas, como las cadenas laterales de alanina, lisina y serina.,
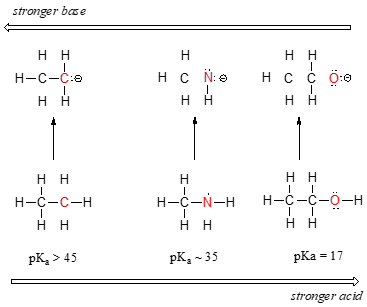
podemos ver una clara tendencia en la acidez a medida que nos movemos de izquierda a derecha a lo largo de la segunda fila de la Tabla periódica de carbono a nitrógeno a oxígeno. La clave para entender esta tendencia es considerar la base conjugada hipotética en cada caso: cuanto más estable (más débil) es la base conjugada, más fuerte es el ácido. Mira dónde termina la carga negativa en cada base conjugada., En el anión etilo, la carga negativa es soportada por el carbono, mientras que en el anión metilamina y el anión metóxido las cargas se encuentran en un nitrógeno y un oxígeno, respectivamente. Recuerde la tendencia periódica en la electronegatividad: también aumenta a medida que nos movemos de izquierda a derecha a lo largo de una fila, lo que significa que el oxígeno es el más electronegativo de los tres, y el carbono el menos. Cuanto más electronegativo es un átomo, mejor es capaz de soportar una carga negativa., Por lo tanto, el anión metóxido es el más estable (energía más baja, menos básico) de las tres bases conjugadas, y el anión etilo es el menos estable (energía más alta, más básico).
Podemos utilizar el mismo conjunto de ideas para explicar la diferencia de basicidad entre el agua y el amoníaco.
mirando el pKavalues para el adecuado conjugadas de ácidos, sabemos que el amoníaco es más básico que el agua. El oxígeno, como el elemento más electronegativo, se aferra más firmemente a su par solitario que el nitrógeno., El par solitario de nitrógeno, por lo tanto, es más probable que se separe y forme un nuevo enlace a un protón, en otras palabras, es más básico. Una vez más, una base conjugada más reactiva (más fuerte) significa un ácido conjugado menos reactivo (más débil).
Cuando se mueve verticalmente dentro de una columna dada de la Tabla periódica, nuevamente observamos una clara tendencia periódica en la acidez. Esto se ilustra mejor con los haluros: la basicidad, al igual que la electronegatividad, aumenta a medida que avanzamos por la columna.,

por el contrario, la acidez en los haloácidos aumenta a medida que avanzamos por la columna.
para dar sentido a esta tendencia, consideraremos una vez más la estabilidad de las bases conjugadas. Debido a que el flúor es el elemento halógeno más electronegativo, podríamos esperar que el flúor también sea el ion halógeno menos básico. Pero, de hecho, es el menos estable, y el más básico! Resulta que cuando se mueve verticalmente en la Tabla periódica, el tamaño del átomo supera su electronegatividad con respecto a la basicidad., El radio atómico del yodo es aproximadamente el doble que el del flúor, por lo que en un ion de yodo, la carga negativa se extiende sobre un volumen significativamente mayor:

esto ilustra un concepto fundamental en química orgánica que es lo suficientemente importante como para poner en rojo:
las cargas electrostáticas, positivas o negativas, son más estables cuando están ‘extendidas’ que cuando están confinadas a un átomo.,
veremos esta idea expresada una y otra vez a lo largo de nuestro estudio de la reactividad orgánica, en muchos contextos diferentes. Por ahora, el concepto se aplica solo a la influencia del radio atómico en la estabilidad de los aniones. Debido a que el fluoruro es el menos estable (más básico) de las bases conjugadas de haluro, el HF es el menos ácido de los haloácidos, solo ligeramente más fuerte que el ácido acético. HI, con un pKa de aproximadamente -9, es uno de los ácidos más fuertes conocidos.
más importante para el estudio de la química orgánica biológica, esta tendencia nos dice que los tioles son más ácidos que los alcoholes., El pKa del grupo tiol en la cadena lateral de cisteína, por ejemplo, es de aproximadamente 8,3, mientras que el pKa para el hidroxl en la cadena lateral de serina es del orden de 17.
para reiterar: la fuerza ácida aumenta a medida que nos movemos hacia la derecha a lo largo de una fila de la Tabla periódica, y a medida que nos movemos hacia abajo en una columna.
dibujar la estructura de la base conjugada que se formaría si el compuesto a continuación fuera a reaccionar con 1 molar equivalente de hidróxido de sodio:
solución
el efecto de resonancia
en la sección anterior centramos nuestra atención en las tendencias periódicas: las diferencias en acidez y basicidad entre grupos donde el protón intercambiable estaba ligado a diferentes elementos., Ahora, es el momento de pensar en cómo la estructura de los diferentes grupos orgánicos contribuye a su relativa acidez o basicidad, incluso cuando estamos hablando del mismo elemento que actúa como donante/aceptor de protones. El primer par de modelos que consideraremos es el etanol y el ácido acético, pero las conclusiones a las que lleguemos serán igualmente válidas para todos los grupos de alcohol y ácido carboxílico.
a pesar de que ambos son ácidos de oxígeno, los valores de pKa del etanol y del ácido acético son muy diferentes. ¿Qué hace que un ácido carboxílico sea mucho más ácido que un alcohol?, Como antes, comenzamos considerando las bases conjugadas.
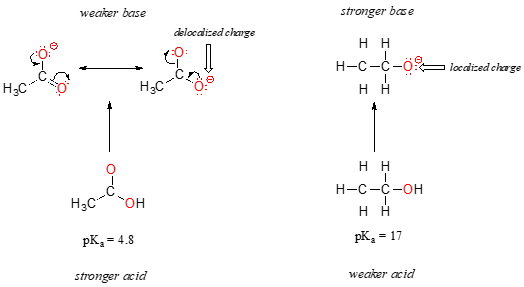
en ambas especies, la carga negativa en la base conjugada es sostenida por un oxígeno, por lo que las tendencias periódicas no pueden ser invocadas. Para el ácido acético, sin embargo, hay una diferencia clave: se puede dibujar un contribuyente de resonancia en el que la carga negativa se localiza en el segundo oxígeno del grupo. Las dos formas de resonancia para la base conjugada son iguales en energía, de acuerdo con nuestras ‘reglas de resonancia’., Lo que esto significa, usted puede recordar, es que la carga negativa en el ion acetato no se encuentra en un oxígeno u otro: más bien se comparte entre los dos. Los químicos usan el término ‘deslocalización de carga’ para describir esta situación. En el ion etóxido, por el contrario, la carga negativa está «bloqueada» en el oxígeno individual – no tiene a dónde ir.,
Ahora es el momento de volver a pensar en esa declaración de la sección anterior que era tan importante que se imprimió en negrita en su propio párrafo – de hecho, es tan importante que lo diremos de nuevo: «las cargas electrostáticas, ya sean positivas o negativas, son más estables cuando están ‘extendidas’ que cuando están confinadas a un átomo.»Ahora, estamos viendo este concepto en otro contexto, donde una carga está siendo ‘extendida’ (en otras palabras, deslocalizada) por resonancia, en lugar de simplemente por el tamaño del átomo involucrado.,
la deslocalización de la carga por resonancia tiene un efecto muy poderoso sobre la reactividad de las moléculas orgánicas, lo suficiente como para explicar la diferencia de más de 12 unidades pKa entre el etanol y el ácido acético (y recuerde, pKa es una expresión logarítmica, por lo que estamos hablando de una diferencia de más de 1012 entre las constantes de acidez para las dos moléculas). El ion acetato es mucho más estable que el ion etóxido, todo debido a los efectos de la deslocalización por resonancia.,
el efecto de resonancia también explica muy bien por qué un átomo de nitrógeno es básico cuando está en una amina, pero no básico cuando es parte de un grupo de amidas. Recuerde que en una amida, hay un carácter significativo de doble enlace al enlace carbono-nitrógeno, debido a un segundo contribuyente de resonancia en el que el par solitario de nitrógeno es parte de un enlace P.
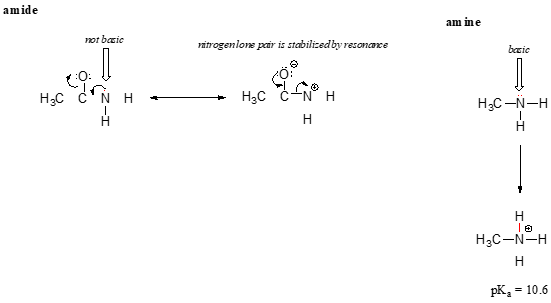
Mientras que el par solitario de electrones de una amina de nitrógeno está «atascado» en un lugar, el par solitario en una nitrógeno amida es transferido por resonancia., Observe que en este caso, estamos extendiendo nuestra Declaración central para decir que la densidad electrónica – en la forma de un par solitario – se estabiliza por deslocalización de resonancia, a pesar de que no hay una carga negativa involucrada. Aquí hay otra manera de pensarlo: el par solitario en un nitrógeno de amida no está disponible para unirse con un protón: estos dos electrones son demasiado ‘cómodos’ al ser parte del sistema deslocalizado de enlace pi. El par solitario en un nitrógeno de Amina, por el contrario, no es parte de un sistema P deslocalizado, y está muy listo para formar un enlace con cualquier protón ácido que pueda estar cerca.,
a menudo se requiere un pensamiento cuidadoso para predecir el protón más ácido en una molécula. El ácido ascórbico, también conocido como vitamina C, tiene un pKa de 4.1.
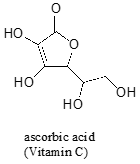
Hay cuatro grupos hidroxilo en la molécula – que es el más ácido? Si consideramos las cuatro posibles bases conjugadas, encontramos que solo hay una para la que podemos deslocalizar la carga negativa sobre dos átomos de oxígeno.
clasifique los compuestos a continuación de más ácidos a menos ácidos, y explique su razonamiento.,c3a3fdb788″>
Solución
El efecto inductivo
Comparar los valores de pKa del ácido acético y sus mono-, di-y tri-derivados clorados:
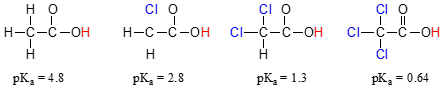
La presencia de los cloros claramente aumenta la acidez de los ácidos carboxílicos de grupo, pero el argumento aquí no tiene que ver con la resonancia de la deslocalización, porque no hay resonancia adicional contribuyentes para el clorados moléculas., Más bien, la explicación de este fenómeno implica algo llamado efecto inductivo. Un átomo de cloro es más electronegativo que un hidrógeno, y por lo tanto es capaz de ‘inducir’, o ‘tirar’ densidad electrónica hacia sí mismo, lejos del grupo carboxilato. En efecto, los átomos de cloro están ayudando a extender aún más la densidad electrónica de la base conjugada, que como sabemos tiene un efecto estabilizador. En este contexto, el sustituyente de cloro se denomina grupo de retiro de electrones., Observe que el efecto reductor de pKa de cada átomo de cloro, aunque significativo, no es tan dramático como el efecto de resonancia deslocalizante ilustrado por la diferencia en los valores de pKa entre un alcohol y un ácido carboxílico. En general, los efectos de resonancia son más poderosos que los efectos inductivos.
el efecto inductivo de retiro de electrones de los cloruros tiene lugar a través de enlaces covalentes, y su influencia disminuye marcadamente con la distancia, por lo que un cloro a dos carbonos de un grupo de ácido carboxílico tiene un efecto disminuido en comparación con un cloro a solo un carbono.
Leave a Reply