periodiska trender
först kommer vi att fokusera på enskilda atomer och tänka på trender i samband med positionen för ett element på det periodiska bordet. Vi använder som våra första modeller de enkla organiska föreningarna etan, metylamin och metanol, men begreppen gäller lika för mer komplexa biomolekyler, såsom sidokedjor av alanin, lysin och serin.,
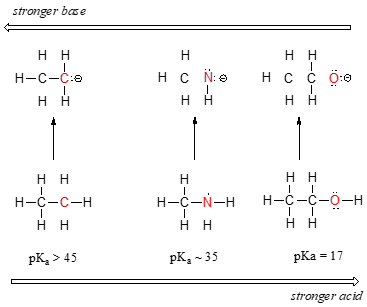
Vi kan se en tydlig trend i surhet när vi flyttar från vänster till höger längs den andra raden i det periodiska tabellen från kol till kväve till syre. Nyckeln till att förstå denna trend är att överväga den hypotetiska konjugatbasen i varje enskilt fall: ju mer stabil (svagare) den konjugerade basen desto starkare är syran. Titta på var den negativa laddningen hamnar i varje konjugatbas., I etylanionen bärs den negativa laddningen av kol, medan i metylaminanjon och metoxidanjon är laddningarna belägna på ett kväve respektive ett syre. Kom ihåg den periodiska trenden i elektronegativitet: det ökar också när vi flyttar från vänster till höger längs en rad, vilket innebär att syre är den mest elektronegativa av de tre och kol minst. Ju mer elektronegativ en atom desto bättre kan den bära en negativ laddning., Således är metoxidanjonen den mest stabila (lägsta energi, minst grundläggande) av de tre konjugatbaserna, och etylanjonen är den minst stabila (högsta energi, mest grundläggande).
Vi kan använda samma uppsättning idéer för att förklara skillnaden i grundlighet mellan vatten och ammoniak.
genom att titta på pKavalues för lämpliga konjugatsyror vet vi att ammoniak är mer grundläggande än vatten. Syre, som det mer elektronegativa elementet, håller sig mer tätt mot sitt ensamma par än kväve., Kväve ensamstående paret är därför mer benägna att bryta sig bort och bilda ett nytt band till en proton – det är med andra ord mer grundläggande. Återigen betyder en mer reaktiv (starkare) konjugatbas en mindre reaktiv (svagare) konjugatsyra.
När vi rör oss vertikalt inom en given kolumn i det periodiska bordet, observerar vi igen en tydlig periodisk trend i surhet. Detta illustreras bäst med haliderna: basicitet, som elektronegativitet, ökar när vi flyttar upp kolumnen.,

omvänt ökar surheten i haloaciderna när vi flyttar ner i kolumnen.
för att förstå denna trend kommer vi återigen att överväga stabiliteten hos de konjugerade baserna. Eftersom fluor är det mest elektronegativa halogenelementet, kan vi förvänta oss att fluorid också är den minst grundläggande halogenjonen. Men i själva verket är det den minst stabila, och den mest grundläggande! Det visar sig att när man rör sig vertikalt i det periodiska bordet trumpar atomens storlek sin elektronegativitet med avseende på basicitet., Atomradien av jod är ungefär dubbelt så stor som fluor, så i en jodjon sprids den negativa laddningen ut över en betydligt större volym:

detta illustrerar ett grundläggande begrepp inom organisk kemi som är tillräckligt viktigt för att sätta i rött:
elektrostatiska laddningar, oavsett om de är positiva eller eller negativ, är stabilare när de är ”utspridda” än när de är begränsade till en atom.,
Vi kommer att se denna idé uttryckas om och om igen under hela vår studie av organisk reaktivitet, i många olika sammanhang. För närvarande tillämpas konceptet endast på påverkan av atomradie på anionstabilitet. Eftersom fluor är den minst stabila (mest grundläggande) av halidkonjugatbaserna är HF den minst sura av haloaciderna, endast något starkare än ättiksyra. Hej, med en pKa på ca -9, är en av de starkaste syrorna som är kända.
ännu viktigare för studien av biologisk organisk kemi, berättar denna trend för oss att tioler är sura än alkoholer., Tiolgruppens PKA på cysteinsidkedjan är till exempel cirka 8,3, medan PKA för hydroxlen på serin sidokedjan är i storleksordningen 17.
för att upprepa: syrastyrkan ökar när vi flyttar till höger längs en rad i det periodiska bordet och när vi flyttar ner en kolumn.
Rita strukturen på den konjugatbas som skulle bildas om föreningen nedan skulle reagera med 1 molar ekvivalent av natriumhydroxid:
lösning
i föregående avsnitt fokuserade vi vår uppmärksamhet på periodiska trender – skillnaderna i surhet och grundlighet mellan grupper där den utbytbara proton var bunden till olika element., Nu är det dags att tänka på hur strukturen hos olika organiska grupper bidrar till deras relativa surhet eller basicitet, även när vi pratar om samma element som fungerar som protondonatorn/acceptorn. Det första modellparet vi kommer att överväga är etanol och ättiksyra, men de slutsatser vi når kommer att vara lika giltiga för alla alkohol-och karboxylsyragrupper.
trots att de båda är syresyror är PKA-värdena för etanol och ättiksyra mycket olika. Vad gör en karboxylsyra så mycket surare än en alkohol?, Som tidigare börjar vi med att överväga de konjugerade baserna.
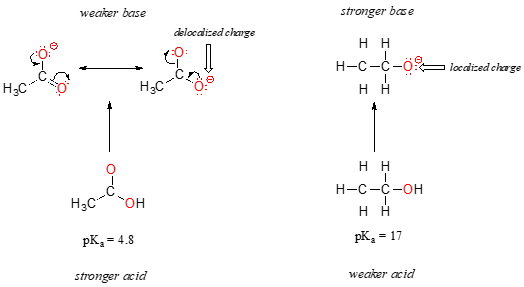
i båda arterna hålls den negativa laddningen på den konjugerade basen av ett syre, så periodiska trender kan inte åberopas. För ättiksyra finns det emellertid en nyckelskillnad: en resonansbidragsgivare kan dras där den negativa laddningen är lokaliserad på gruppens andra syre. De två resonansformerna för den konjugerade basen är lika i energi, enligt våra ”resonansregler”., Vad det här betyder, kanske du kommer ihåg, är att den negativa laddningen på acetatjonen inte ligger på ett syre eller det andra: det är snarare delat mellan de två. Kemister använder termen ”delocalization kostnad” för att beskriva denna situation. I etoxidjonen däremot är den negativa laddningen ”låst” på det enda syret – det har ingen annanstans att gå.,
nu är det dags att tänka tillbaka till det uttalandet från föregående avsnitt som var så viktigt att det blev tryckt i fetstil i sitt eget stycke – det är faktiskt så viktigt att vi bara säger det igen: ”elektrostatiska laddningar, vare sig positiva eller negativa, är stabilare när de är ”utspridda” än när de är begränsade till en atom.”Nu ser vi detta koncept i ett annat sammanhang, där en laddning är ”utspridd” (med andra ord delokaliserad) genom resonans, snarare än bara av storleken på den involverade atomen.,
avlokaliseringen av laddning genom resonans har en mycket kraftfull effekt på reaktiviteten hos organiska molekyler, tillräckligt för att redogöra för skillnaden mellan över 12 PKA-enheter mellan etanol och ättiksyra (och kom ihåg att pKa är ett logguttryck, så vi talar om en skillnad på över 1012 mellan surhetskonstanterna för de två molekylerna). Acetatjonen är så mycket stabilare än etoxidjonen, allt på grund av effekterna av resonansdelokalisering.,
resonanseffekten förklarar också snyggt varför en kväveatom är grundläggande när den är i en amin, men inte grundläggande när den ingår i en amidgrupp. Minns att i en amid, det finns betydande dubbelbindning karaktär till kol-kvävebindningen, på grund av en andra resonans bidragsgivare där kväve ensamstående paret är en del av en p-bindning.
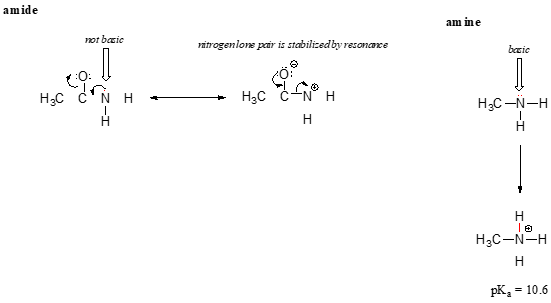
medan elektronens Lone par av ett aminkväve är ”fast” på ett ställe, delokaliseras det lone paret på ett amidkväve av resonans., Observera att vi i detta fall utvidgar vårt centrala uttalande för att säga att elektrondensitet – i form av ett ensam par – stabiliseras av resonansdelokalisering, även om det inte finns någon negativ laddning inblandad. Här är ett annat sätt att tänka på det: det ensamma paret på ett amidkväve är inte tillgängligt för bindning med en proton – dessa två elektroner är för ”bekväma” som en del av det delokaliserade pi-bindningssystemet. Det ensamma paret på ett aminkväve är däremot inte en del av ett delokaliserat p-system, och är mycket redo att bilda en bindning med någon sur proton som kan vara i närheten.,
ofta kräver det en noggrann tanke att förutsäga den mest sura proton på en molekyl. Askorbinsyra, även känd som Vitamin C, har en PKA av 4.1.
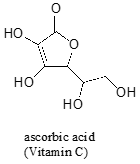
det finns fyra hydroxylgrupper på denna molekyl – vilken är den mest sura? Om vi betraktar alla fyra möjliga konjugatbaser finner vi att det bara finns en för vilken vi kan delokalisera den negativa laddningen över två syreatomer.
rangordna föreningarna nedan från de flesta sura till minst sura, och förklara ditt resonemang.,C3a3fdb788″>
lösning
den induktiva effekten
jämför PKA-värdena för ättiksyra och dess mono -, di -, och Tri-klorerade derivat:
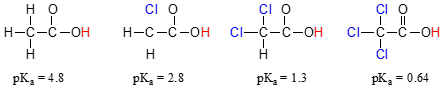
närvaron av klorinerna ökar tydligt surheten hos karboxylsyragruppen, men argumentet här behöver inte göra med resonansdelokalisering, eftersom inga ytterligare resonansbidragsgivare kan dras för de klorerade molekylerna., Snarare innebär förklaringen till detta fenomen något som kallas den induktiva effekten. En kloratom är mer elektronegativ än ett väte och kan därmed ”inducera” eller ” dra ” elektrondensitet mot sig själv, bort från karboxylatgruppen. I själva verket bidrar kloratomerna till att ytterligare sprida ut elektrondensiteten hos den konjugerade basen, som som vi vet har en stabiliserande effekt. I detta sammanhang kallas klorsubstituenten en elektronutdragande grupp., Observera att den PKA-sänkande effekten av varje kloratom, medan signifikant, inte är lika dramatisk som delokaliserande resonanseffekten illustrerad av skillnaden i PKA-värden mellan en alkohol och en karboxylsyra. I allmänhet är resonanseffekter kraftfullare än induktiva effekter.
den induktiva elektronutdragningseffekten av klorinerna sker genom kovalenta bindningar, och dess inflytande minskar markant med avstånd – sålunda har en klor två kol bort från en karboxylsyragrupp en minskad effekt jämfört med en klor bara ett kol bort.
Leave a Reply