obiective de învățare
- definiți acidul Arrhenius.
- dați exemple de acizi Arrhenius.
- descrieți ionul de hidroniu.
- definiți baza Arrhenius.
- dați exemple de baze Arrhenius.
acizii Arrhenius
nu respirați prea adânc.
 Venus este planeta cea mai apropiată de noi, dar are un mediu foarte diferit și ostil.
Venus este planeta cea mai apropiată de noi, dar are un mediu foarte diferit și ostil.
are o temperatură a suprafeței care este în medie de aproximativ 450°C., Atmosfera este compusă din dioxid de carbon, dar norii de acid sulfuric se deplasează prin atmosfera superioară, ajutând la crearea condițiilor extrem de neprietenoase. Din cauza acestor condiții, Venus nu este un loc pe care doriți să îl vizitați în vacanță.chimistul suedez Svante Arrhenius (1859-1927) a fost primul care a propus o teorie care să explice comportamentul observat al acizilor și bazelor. Datorită capacității lor de a conduce un curent, el știa că atât acizii, cât și bazele conțin ioni în soluție., Un acid Arrhenius este un compus, care ionizează pentru a produce ioni de hidrogen (H + ) în soluție apoasă.
acizii sunt compuși moleculari cu atomi de hidrogen ionizabili. Numai atomii de hidrogen care fac parte dintr-o legătură covalentă foarte polară sunt ionizabili. Clorura de hidrogen (HCl) este un gaz la temperatura camerei și sub presiune normală. Legătura H-Cl din clorura de hidrogen este o legătură polară. Atomul de hidrogen este deficitar de electroni din cauza electronegativității mai mari a atomului de clor., În consecință, atomul de hidrogen este atras de perechea singuratică de electroni dintr-o moleculă de apă atunci când HCl este dizolvat în apă. Rezultatul este că legătura H-Cl se rupe, ambii electroni de legătură rămânând Cu Cl, formând un ion de clorură. Ionul H + se atașează de molecula de apă, formând un ion poliatomic numit Ion de hidroniu. Ionul hidroniu (H 3 O + ) poate fi considerat ca o moleculă de apă cu un ion de hidrogen atașat.

Figura 1. Formarea unui ion de hidroniu.,
Ecuații arată ionizare a unui acid în apă sunt frecvent simplificată prin omiterea moleculă de apă:
![]()
Aceasta este doar o simplificare a ecuația anterioară, dar este frecvent utilizat. Orice ioni de hidrogen dintr-o soluție apoasă vor fi atașați moleculelor de apă sub formă de ioni de hidroniu.
 nu toți atomii de hidrogen din compușii moleculari sunt ionizabili. În metan (CH 4 ), atomii de hidrogen sunt legați covalent de carbon în legături care sunt doar ușor polare., Atomii de hidrogen nu sunt capabili de ionizare și metanul nu are proprietăți acide. Acidul Acetic (CH 3 COOH) aparține unei clase de acizi numiți acizi organici. Există patru atomi de hidrogen în moleculă, dar numai hidrogenul care este legat de un atom de oxigen este ionizabil.legătura O-H poate fi ionizată pentru a produce ionul H + și ionul acetat. Ceilalți atomi de hidrogen din această moleculă nu sunt acizi.,e common acids:
nu toți atomii de hidrogen din compușii moleculari sunt ionizabili. În metan (CH 4 ), atomii de hidrogen sunt legați covalent de carbon în legături care sunt doar ușor polare., Atomii de hidrogen nu sunt capabili de ionizare și metanul nu are proprietăți acide. Acidul Acetic (CH 3 COOH) aparține unei clase de acizi numiți acizi organici. Există patru atomi de hidrogen în moleculă, dar numai hidrogenul care este legat de un atom de oxigen este ionizabil.legătura O-H poate fi ionizată pentru a produce ionul H + și ionul acetat. Ceilalți atomi de hidrogen din această moleculă nu sunt acizi.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., Acidul clorhidric și acidul acetic sunt acizi monoprotici. Un acid poliprotic este un acid care conține mai multe hidrogeni ionizabili. Cele mai frecvente acizi poliprotici sunt fie diprotici (cum ar fi H 2 SO 4), fie triprotici (cum ar fi H 3 PO 4 ).
bazele Arrhenius
pentru ce se poate folosi aceasta?

hidroxidul de sodiu este un produs chimic versatil. Poate fi folosit în scopuri atât de banale, cum ar fi curățarea scurgerilor înfundate. Mai multe preparate comerciale conțin hidroxid de sodiu în acest scop. De asemenea, are o serie de aplicații în domeniul procesării produselor alimentare., Înghețata este îngroșată folosind NaOH. Dacă măslinele sunt înmuiate într-o soluție care conține hidroxid de sodiu și alte substanțe chimice, măslinele vor deveni negre. Covrigii moi sunt făcuți mestecați prin aplicarea hidroxidului de sodiu în alimente. Acest compus a fost utilizat pe scară largă în sinteza materialelor plastice, pentru gravarea aluminiului, pentru îndepărtarea vopselei și este utilizat în dehorning-ul bovinelor (în cazul în care este nevoie de tine).
bazele Arrhenius
o bază Arrhenius este un compus, care ionizează pentru a produce ioni de hidroxid (OH− ) în soluție apoasă., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., După dizolvarea în apă, fiecare disociază într-un cation metalic și ionul de hidroxid.
![]()
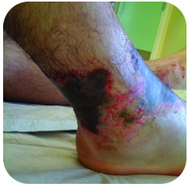
Figura 2. Acest picior are arsuri severe datorită contactului prelungit cu o soluție de hidroxid de sodiu, cunoscută și sub denumirea de leșie.hidroxidul de sodiu este o substanță foarte caustică cunoscută și sub denumirea de leșie. Leșia este folosită ca un produs de curățare riguros și este un ingredient în fabricarea săpunurilor. Trebuie luate măsuri de precauție cu baze puternice, cum ar fi hidroxidul de sodiu, deoarece expunerea poate duce la arsuri grave (vezi Figura 2 ).,sodiul aparține grupului de elemente numite metale alcaline. O soluție alcalină este un alt nume pentru o soluție care este de bază. Toate metalele alcaline reacționează ușor cu apa pentru a produce hidroxidul metalic și hidrogenul gazos. Soluțiile rezultate sunt de bază.
bazele care constau dintr-un cation de metal alcalin și anionul hidroxid sunt foarte solubile în apă. Compușii metalelor din grupa 2 (metalele alcalino-pământoase) sunt, de asemenea, de bază. Cu toate acestea, acești compuși nu sunt, în general, la fel de solubili în apă., Prin urmare, reacțiile de disociere pentru acești compuși sunt prezentate ca reacții de echilibru.
Aceste relativ insolubile hidroxizi au fost unii dintre compușii discutate în contextul solubilitatea produsului constantă ![]() . Solubilitatea hidroxidului de magneziu este de 0,0084 g pe litru de apă la 25°C. datorită solubilității sale scăzute, hidroxidul de magneziu nu este la fel de periculos ca hidroxidul de sodiu., De fapt, hidroxidul de magneziu este ingredientul activ într-un produs numit lapte de magnezie, care este utilizat ca antacid sau laxativ ușor.
. Solubilitatea hidroxidului de magneziu este de 0,0084 g pe litru de apă la 25°C. datorită solubilității sale scăzute, hidroxidul de magneziu nu este la fel de periculos ca hidroxidul de sodiu., De fapt, hidroxidul de magneziu este ingredientul activ într-un produs numit lapte de magnezie, care este utilizat ca antacid sau laxativ ușor.
rezumat
- acidul Arrhenius este definit.
- Exemple de acizi Arrhenius sunt date.
- baza Arrhenius este definită.
- Exemple de baze Arrhenius sunt date.
Practica
Citeste materialul de la link-ul de mai jos și răspundeți la următoarele întrebări:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- ceea Ce a fost Arrhenius prima idee științifică?
- ce a crezut Comitetul său de doctorat despre asta?,
- ce a câștigat pentru această idee?
- scrieți ecuația generică pentru disocierea unui acid Arrhenius.
recenzie
acizi Arrhenius
- ce este un acid Arrhenius?
- ce este un ion de hidroniu?
- este H2SO4 un acid monoprotic sau poliprotic?
bazele Arrhenius
- ce este o bază Arrhenius?
- care este o reacție care va forma o bază Arrhenius?
- bazele alcalino-pământoase sunt foarte solubile în apă?
Leave a Reply