tendințele Periodice
în Primul rând, ne vom concentra pe atomi individuali, și cred că despre tendințele asociate cu poziția unui element în tabelul periodic. Vom folosi ca primele noastre modele compușii organici simpli etan, metilamină și metanol, dar conceptele se aplică în mod egal biomoleculelor mai complexe, cum ar fi lanțurile laterale ale alaninei, lizinei și serinei.,
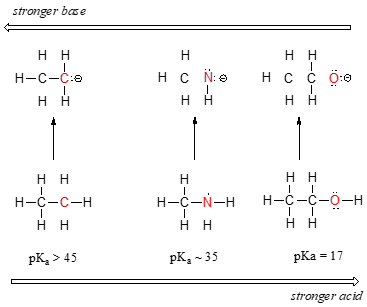
putem vedea o tendință clară în aciditate, cum trecem de la stânga la dreapta în al doilea rând din tabelul periodic de carbon, azot și oxigen. Cheia înțelegerii acestei tendințe este de a lua în considerare baza ipotetică conjugată în fiecare caz: cu cât este mai stabilă (mai slabă) baza conjugată, cu atât acidul este mai puternic. Uită-te unde se termină încărcarea negativă în fiecare bază conjugată., În anionul etilic, sarcina negativă este suportată de carbon, în timp ce în anionul de metilamină și anionul de metoxid sarcinile sunt localizate pe un azot și, respectiv, pe un oxigen. Amintiți-vă tendința periodică a electronegativității: crește, de asemenea, pe măsură ce ne mișcăm de la stânga la dreapta de-a lungul unui rând, ceea ce înseamnă că oxigenul este cel mai electronegativ dintre cele trei, iar carbonul cel mai puțin. Cu cât este mai electronegativ un atom, cu atât mai bine este capabil să suporte o sarcină negativă., Astfel, anionul de metoxid este cel mai stabil (cea mai mică energie, cel mai puțin bazic) dintre cele trei baze conjugate, iar anionul etilic este cel mai puțin stabil (cea mai mare energie, cea mai de bază).putem folosi același set de idei pentru a explica diferența de bazicitate dintre apă și amoniac.
uitandu-se la pKavalues corespunzătoare conjugat acizi, știm că amoniacul este mai mult de bază decât apa. Oxigenul, ca element mai electronegativ, ține mai strâns de perechea sa singură decât azotul., Prin urmare, perechea singură de azot este mai probabil să se desprindă și să formeze o nouă legătură cu un proton – este, cu alte cuvinte, mai de bază. Încă o dată, o bază conjugată mai reactivă (mai puternică) înseamnă un acid conjugat mai puțin reactiv (mai slab).când ne mișcăm vertical într-o anumită coloană a tabelului periodic, observăm din nou o tendință periodică clară a acidității. Acest lucru este cel mai bine ilustrat cu halogenurile: bazicitatea, ca și electronegativitatea, crește pe măsură ce urcăm coloana.,

în Schimb, aciditate în haloacids crește așa cum am muta în jos pe coloană.pentru a înțelege această tendință, vom lua în considerare încă o dată stabilitatea bazelor conjugate. Deoarece fluorul este elementul halogen cel mai electronegativ, ne-am putea aștepta ca fluorura să fie și ionul halogen cel mai puțin de bază. Dar, de fapt, este cel mai puțin stabil și cel mai de bază! Se pare că atunci când se deplasează vertical în tabelul periodic, dimensiunea atomului își depășește electronegativitatea în ceea ce privește bazicitatea., Atomic raza de iod este de aproximativ de două ori de fluor, astfel încât într-un iod ion, sarcina negativa se întinde pe un volum semnificativ mai mare:

Acest lucru ilustrează un concept fundamental în chimia organică, care este destul de important pentru a pune în roșu:
sarcini Electrostatice, indiferent dacă sunt pozitive sau negative, sunt mai stabile atunci când acestea sunt ‘întins’ decât atunci când acestea sunt limitate la un singur atom.,vom vedea această idee exprimată din nou și din nou pe parcursul studiului nostru despre reactivitatea organică, în multe contexte diferite. Deocamdată, conceptul este aplicat numai influenței razei atomice asupra stabilității anionilor. Deoarece fluorul este cel mai puțin stabil (cel mai bazic) dintre bazele conjugate cu halogenuri, HF este cel mai puțin acid dintre haloacizi, doar puțin mai puternic decât acidul acetic. Bună, cu un pKa de aproximativ -9, este unul dintre cei mai puternici acizi cunoscuți.mai important pentru studiul chimiei organice biologice, această tendință ne spune că tiolii sunt mai acide decât alcoolii., PKa din grupul tiol pe lanțul lateral al cisteinei, de exemplu, este de aproximativ 8,3, în timp ce PKA pentru hidroxl pe lanțul lateral serinic este de ordinul 17.pentru a reitera: rezistența acidă crește pe măsură ce ne deplasăm spre dreapta de-a lungul unui rând al tabelului periodic și pe măsură ce ne mișcăm în jos o coloană.
Desenați structura de baza conjugată care s-ar forma în cazul în care compusul de mai jos au fost de a reacționa cu 1 molară echivalentă de hidroxid de sodiu:
Soluție
efectul De rezonanta
În secțiunea anterioară ne-am concentrat atenția pe tendințele periodice – diferențele în aciditatea și bazicitatea între grupuri de unde de schimb de protoni a fost obligat la diferite elemente., Acum, este timpul să ne gândim la modul în care structura diferitelor grupuri organice contribuie la aciditatea sau bazicitatea lor relativă, chiar și atunci când vorbim despre același element care acționează ca donatorul/acceptorul de protoni. Prima pereche de model pe care o vom lua în considerare este etanolul și acidul acetic, dar concluziile la care ajungem vor fi la fel de valabile pentru toate grupurile de alcool și acid carboxilic.în ciuda faptului că sunt ambii acizi de oxigen, valorile pKa ale etanolului și acidului acetic sunt foarte diferite. Ce face un acid carboxilic atât de mult mai acid decât un alcool?, Ca și înainte, începem prin a lua în considerare bazele conjugate.
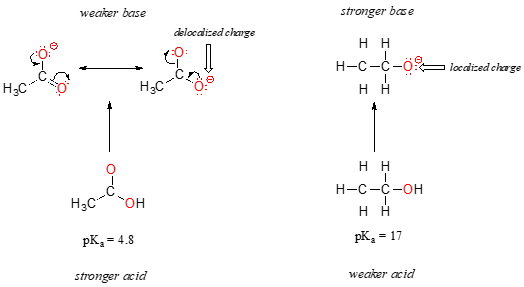
La ambele specii, la sarcină negativă pe bază conjugată este deținut de oxigen, astfel încât tendințele periodice nu poate fi invocat. Cu toate acestea, pentru acidul acetic există o diferență cheie: se poate trage un contribuitor de rezonanță în care sarcina negativă este localizată pe cel de-al doilea oxigen al grupului. Cele două forme de rezonanță pentru baza conjugată sunt egale în energie, conform „regulilor noastre de rezonanță”., Ceea ce înseamnă acest lucru, vă puteți aminti, este că sarcina negativă pe ionul acetat nu este localizată pe un oxigen sau pe celălalt: mai degrabă este împărțită între cele două. Chimiștii folosesc termenul „delocalizare a încărcăturii” pentru a descrie această situație. În ionul de etoxid, prin contrast, sarcina negativă este „blocată” pe oxigenul unic – nu are unde să meargă.,
acum este momentul să ne gândim la acea afirmație din secțiunea anterioară, care a fost atât de importantă încât a fost tipărită cu caractere aldine în propriul paragraf – de fapt, este atât de important încât o vom spune din nou: „încărcările electrostatice, pozitive sau negative, sunt mai stabile atunci când sunt „răspândite” decât atunci când sunt limitate la un atom.”Acum, vedem acest concept într-un alt context, în care o sarcină este „răspândită” (cu alte cuvinte, delocalizată) prin rezonanță, mai degrabă decât pur și simplu prin dimensiunea atomului implicat.,
delocalizarea taxa de rezonanță are un efect foarte puternic asupra reactivității de molecule organice, suficient pentru a ține cont de diferența de peste 12 pKa unități între etanol și acid acetic (și amintiți-vă, pKa este un jurnal de exprimare, deci vorbim despre o diferență de peste 1012 între constantele de aciditate pentru cele două molecule). Ionul acetat este mult mai stabil decât ionul de etoxid, toate datorită efectelor delocalizării prin rezonanță.,efectul de rezonanță explică, de asemenea, de ce un atom de azot este de bază atunci când este într-o amină, dar nu de bază atunci când face parte dintr-o grupare amidă. Reamintim că într-o amidă, există un caracter semnificativ de legătură dublă la legătura carbon-azot, datorită unui al doilea contribuitor de rezonanță în care perechea singură de azot face parte dintr-o legătură P.
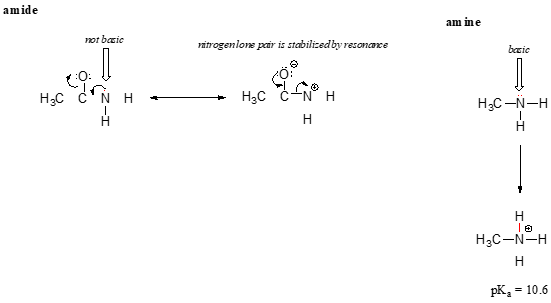
în Timp ce electronul singuratic pereche de amine azot este „blocat” într-un loc singuratic pe o pereche de amidură de azot este delocalizat de rezonanță., Observați că, în acest caz, extindem Declarația noastră centrală pentru a spune că densitatea electronilor – sub forma unei perechi singure – este stabilizată prin delocalizarea rezonanței, chiar dacă nu există o sarcină negativă implicată. Iată un alt mod de a gândi: perechea singuratică pe un azot de amidă nu este disponibilă pentru lipirea cu un proton – acești doi electroni sunt prea „confortabili” făcând parte din sistemul de legare pi delocalizat. Perechea singuratică pe un azot aminic, prin contrast, nu face parte dintr-un sistem p delocalizat și este foarte gata să formeze o legătură cu orice proton acid care ar putea fi în apropiere.,adesea este nevoie de o gândire atentă pentru a prezice protonul cel mai acid pe o moleculă. Acidul Ascorbic, cunoscut și sub denumirea de vitamina C, are un pKa de 4.1.
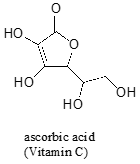
Există patru grupări hidroxil pe această moleculă – care este cel mai acid? Dacă luăm în considerare toate cele patru baze conjugate posibile, descoperim că există doar una pentru care putem delocaliza sarcina negativă asupra a doi atomi de oxigen.
clasificați compușii de mai jos de la cel mai acid la cel mai puțin acid și explicați-vă raționamentul.,c3a3fdb788″>
Soluție
efectul inductiv
Compara valorile pKa de acid acetic și de mono-, di-și tri-derivați clorurați:
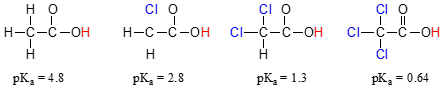
prezența ftalocianine clar crește aciditatea acidului carboxilic grup, dar argumentul aici nu are de-a face cu rezonanță delocalizare, pentru că nici o suplimentare de rezonanță contribuabili pot fi trase pentru molecule de clor., Mai degrabă, explicația acestui fenomen implică ceva numit efect inductiv. Un atom de clor este mai electronegativ decât un hidrogen și, astfel, este capabil să „inducă” sau să „tragă” densitatea electronică spre sine, departe de gruparea carboxilată. De fapt, atomii de clor ajută la răspândirea în continuare a densității electronice a bazei conjugate, care, după cum știm, are un efect stabilizator. În acest context, substituentul de clor se numește grup de retragere a electronilor., Observați că efectul de scădere a pKa al fiecărui atom de clor, deși semnificativ, nu este la fel de dramatic ca efectul de rezonanță de delocalizare ilustrat de diferența de valori pKa între un alcool și un acid carboxilic. În general, efectele de rezonanță sunt mai puternice decât efectele inductive.
inductiv electron-retragerea efect de ftalocianine are loc prin legături covalente, iar influența ei scade semnificativ cu distanța – o astfel de clor doi atomi de carbon departe de un acid carboxilic grup are un efect scăzut în comparație cu clor doar unul de carbon departe.
Leave a Reply