objectivos de aprendizagem
- Define ácido de Arrhenius.dê exemplos de ácidos de Arrhenius.descreva o íon hidrônio.Define base de Arrhenius.dê exemplos de bases de Arrhenius.
ácidos de Arrhenius
não respire demasiado profundamente.
 Vénus é o planeta mais próximo de nós, mas tem um ambiente muito diferente e hostil.tem uma temperatura de superfície média de cerca de 450 ° C., A atmosfera é composta de dióxido de carbono, mas nuvens de ácido sulfúrico se movem através da atmosfera superior, ajudando a criar as condições extremamente hostis. Devido a estas condições, Vênus não é um lugar que você quer visitar em férias.
Vénus é o planeta mais próximo de nós, mas tem um ambiente muito diferente e hostil.tem uma temperatura de superfície média de cerca de 450 ° C., A atmosfera é composta de dióxido de carbono, mas nuvens de ácido sulfúrico se movem através da atmosfera superior, ajudando a criar as condições extremamente hostis. Devido a estas condições, Vênus não é um lugar que você quer visitar em férias.
Arrhenius Ácidos
químico sueco Svante Arrhenius (1859-1927) foi o primeiro a propor uma teoria para explicar o comportamento observado de ácidos e bases. Devido à sua capacidade de conduzir uma corrente, ele sabia que ambos os ácidos e bases continham íons em solução., Um ácido de Arrhenius é um composto que ioniza para produzir íons de hidrogênio (H + ) em solução aquosa.os ácidos são compostos moleculares com átomos de hidrogênio ionizáveis. Apenas átomos de hidrogênio que fazem parte de uma ligação covalente altamente polar são ionizáveis. Cloreto de hidrogênio (HCl) é um gás à temperatura ambiente e sob pressão normal. A ligação H-Cl em cloreto de hidrogênio é uma ligação polar. O átomo de hidrogênio é deficiente em elétrons devido à maior eletronegatividade do átomo de cloro., Consequentemente, o átomo de hidrogênio é atraído para o par solitário de elétrons em uma molécula de água quando HCl é dissolvido em água. O resultado é que a ligação H-Cl quebra, com ambos os elétrons de ligação permanecendo com o Cl, formando um íon cloreto. O íon H + liga-se à molécula de água, formando um íon poliatômico chamado íon hidrônio. O íon hidrônio (H 3 o+) pode ser considerado como uma molécula de água com um íon hidrogênio ligado.

a Figura 1. Formação de um íon hidrônio.,
Equações mostrando a ionização de um ácido em água são frequentemente simplificada, omitindo a molécula de água:
![]()
Esta é apenas uma simplificação da equação anterior, mas é comumente usado. Quaisquer íons de hidrogênio em uma solução aquosa serão ligados a moléculas de água como íons de hidrônio.
 nem todos os átomos de hidrogénio em compostos moleculares são ionizáveis. No metano (CH 4), os átomos de hidrogênio estão covalentemente ligados ao carbono em ligações que são apenas ligeiramente polares., Os átomos de hidrogênio não são capazes de ionizar e o metano não tem propriedades ácidas. Ácido acético (CH 3 COOH) pertence a uma classe de ácidos chamados ácidos orgânicos. Existem quatro átomos de hidrogênio na molécula, mas apenas um hidrogênio que está ligado a um átomo de oxigênio é ionizável.
nem todos os átomos de hidrogénio em compostos moleculares são ionizáveis. No metano (CH 4), os átomos de hidrogênio estão covalentemente ligados ao carbono em ligações que são apenas ligeiramente polares., Os átomos de hidrogênio não são capazes de ionizar e o metano não tem propriedades ácidas. Ácido acético (CH 3 COOH) pertence a uma classe de ácidos chamados ácidos orgânicos. Existem quatro átomos de hidrogênio na molécula, mas apenas um hidrogênio que está ligado a um átomo de oxigênio é ionizável.
a ligação O-H pode ser ionizada para produzir o ião H + e o ião acetato. Os outros átomos de hidrogênio nesta molécula não são ácidos.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., Ácido clorídrico e ácido acético são ácidos monopróticos. Um ácido poliprótico é um ácido que contém múltiplos hidrogénios ionizáveis. A maioria dos ácidos polipróticos mais comuns são dipróticos (tais como H 2 SO 4 ) ou tripróticos (tais como H 3 PO 4 ).
bases de Arrhenius
para que é que isto pode ser utilizado?

hidróxido de sódio é um produto químico versátil. Pode ser usado para fins mundanos como limpeza de drenos entupidos. Várias preparações comerciais contêm hidróxido de sódio para este efeito. Ele também tem uma série de aplicações no campo de processamento de alimentos., O sorvete é espessado usando NaOH. Se as azeitonas forem embebidas numa solução contendo hidróxido de sódio e outros produtos químicos, as azeitonas ficarão Negras. Pretzels moles são feitos mastigados pela aplicação de hidróxido de sódio no alimento. Este composto tem sido amplamente utilizado na síntese de plásticos, para a gravação de alumínio, para remoção de tinta, e é empregado na descorna de gado (no caso de que é uma necessidade que você tem).
Bases de Arrhenius
uma base de Arrhenius é um composto, que ioniza para produzir íons de hidróxido (OH− ) em solução aquosa., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., Ao dissolver-se na água, cada um se dissocia em um catião metálico e o íon hidróxido.
![]()
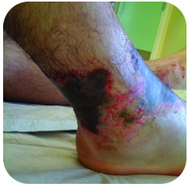
Figura 2. Este pé tem queimaduras graves devido ao contacto prolongado com uma solução de hidróxido de sódio, também conhecida como lixívia.
hidróxido de sódio é uma substância muito cáustica também conhecida como lixívia. A lixívia é utilizada como um produto de limpeza rigoroso e é um ingrediente na fabricação de sabonetes. Deve ter-se cuidado com bases fortes como o hidróxido de sódio, uma vez que a exposição pode levar a queimaduras graves (ver Figura 2 ).,
O sódio pertence ao grupo de elementos chamados metais alcalinos. Uma solução alcalina é outro nome para uma solução que é básica. Todos os metais alcalinos reagem prontamente com a água para produzir o hidróxido de metal e gás hidrogênio. As soluções resultantes são básicas.
Bases que consistem num catião metal alcalino e o ânion hidróxido são todos muito solúveis em água. Compostos dos metais do grupo 2 (metais alcalino-terrosos) também são básicos. No entanto, estes compostos não são geralmente tão solúveis em água., Portanto, as reações de dissociação para estes compostos são mostradas como reações de equilíbrio.
estes hidróxidos relativamente insolúveis foram alguns dos compostos discutidos no contexto da constante do produto da solubilidade ![]() . A solubilidade do hidróxido de magnésio é de 0,0084 g por litro de água a 25°C. Devido à sua baixa solubilidade, o hidróxido de magnésio não é tão perigoso como o hidróxido de sódio., De facto, o hidróxido de magnésio é a substância activa de um produto denominado leite de Magnésia, que é utilizado como antiácido ou laxante ligeiro.
. A solubilidade do hidróxido de magnésio é de 0,0084 g por litro de água a 25°C. Devido à sua baixa solubilidade, o hidróxido de magnésio não é tão perigoso como o hidróxido de sódio., De facto, o hidróxido de magnésio é a substância activa de um produto denominado leite de Magnésia, que é utilizado como antiácido ou laxante ligeiro.
resumo
- ácido de Arrhenius está definido.exemplos de ácidos de Arrhenius são dados.
- ase de Arrhenius é definida.exemplos de bases de Arrhenius são dados.
prática
Leia o material na ligação abaixo e responda às seguintes perguntas:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- Qual foi a primeira ideia científica de Arrhenius?o que seu comitê de Ph. D pensou sobre isso?,o que é que ele ganhou com esta ideia?
- Write the generic equation for dissociation of an Arrhenius acid.o que é um ácido de Arrhenius?o que é um íon hidrônio?H2SO4 é um ácido monoprótico ou poliprotico?o que é uma base de Arrhenius?qual é uma reação que formará uma base de Arrhenius?as bases alcalinas da terra são muito solúveis em água?
Leave a Reply