leerdoelstellingen
- definiëren Arrhenius-zuur.
- geef voorbeelden van Arrhenius-zuren.
- beschrijf het hydroniumion.
- Bepaal de Arrhenius-basis.
- geef voorbeelden van Arrhenius-bases.
Arrhenius-zuren
adem niet te diep in.
 Venus is de planeet die het dichtst bij ons ligt, maar heeft een heel andere en vijandige omgeving.
Venus is de planeet die het dichtst bij ons ligt, maar heeft een heel andere en vijandige omgeving.
Het heeft een oppervlaktetemperatuur van gemiddeld ongeveer 450°C., De atmosfeer bestaat uit kooldioxide, maar wolken van zwavelzuur bewegen door de bovenste atmosfeer, waardoor de extreem onvriendelijke omstandigheden ontstaan. Vanwege deze omstandigheden is Venus niet een plek die je op vakantie wilt bezoeken.
Arrhenius zuren
De Zweedse chemicus Svante Arrhenius (1859-1927) was de eerste die een theorie voorstelde om het waargenomen gedrag van zuren en basen te verklaren. Vanwege hun vermogen om een stroom te geleiden, wist hij dat zowel zuren als basen ionen in oplossing bevatten., Een Arrhenius zuur is een verbinding, die ioniseert om waterstofionen (H + ) in waterige oplossing te produceren.
zuren zijn moleculaire verbindingen met ioniseerbare waterstofatomen. Alleen waterstofatomen die deel uitmaken van een zeer polaire covalente binding zijn ioniseerbaar. Waterstofchloride (HCl) is een gas bij kamertemperatuur en onder normale druk. De H-Cl-binding in waterstofchloride is een polaire binding. Het waterstofatoom is elektronendeficiënt vanwege de hogere elektronegativiteit van het chlooratoom., Bijgevolg wordt het waterstofatoom aangetrokken tot het eenzame paar elektronen in een watermolecuul wanneer HCl in water wordt opgelost. Het resultaat is dat de H-Cl-binding breekt, waarbij beide bindingselektronen bij de Cl blijven en een chloride-ion vormen. Het H + – ion hecht zich aan het watermolecuul en vormt een polyatomisch ion dat het hydronium-ion wordt genoemd. Het hydronium-ion (H 3 o+) kan worden gezien als een watermolecuul met een daaraan gekoppeld waterstof-ion.

figuur 1. Vorming van een hydronium-ion.,
vergelijkingen die de ionisatie van een zuur in water laten zien, worden vaak vereenvoudigd door het watermolecuul weg te laten:
![]()
Dit is slechts een vereenvoudiging van de vorige vergelijking, maar het wordt vaak gebruikt. Alle waterstofionen in een waterige oplossing worden als hydroniumionen aan watermoleculen bevestigd.
 niet alle waterstofatomen in moleculaire verbindingen zijn ioniseerbaar. In methaan (CH 4) zijn de waterstofatomen covalent gebonden aan koolstof in bindingen die slechts licht polair zijn., De waterstofatomen kunnen niet ioniseren en methaan heeft geen zure eigenschappen. Azijnzuur (CH 3 COOH) behoort tot een klasse van zuren genaamd organische zuren. Er zijn vier waterstofatomen in het molecuul, maar alleen de ene waterstof die is gebonden aan een zuurstofatoom is ioniseerbaar.
niet alle waterstofatomen in moleculaire verbindingen zijn ioniseerbaar. In methaan (CH 4) zijn de waterstofatomen covalent gebonden aan koolstof in bindingen die slechts licht polair zijn., De waterstofatomen kunnen niet ioniseren en methaan heeft geen zure eigenschappen. Azijnzuur (CH 3 COOH) behoort tot een klasse van zuren genaamd organische zuren. Er zijn vier waterstofatomen in het molecuul, maar alleen de ene waterstof die is gebonden aan een zuurstofatoom is ioniseerbaar.
De O-H-binding kan worden geïoniseerd om het H + – ion en het acetaat-ion te verkrijgen. De andere waterstofatomen in dit molecuul zijn niet zuur.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., Zoutzuur en azijnzuur zijn monoprotische zuren. Een polyprotinezuur is een zuur dat meerdere ioniseerbare hydrogenen bevat. De meest voorkomende polyprotische zuren zijn ofwel diprotisch (zoals H 2 SO 4 ) of triprotisch (zoals H 3 PO 4 ).
Arrhenius-Bases
waarvoor kan dit worden gebruikt?

natriumhydroxide is een veelzijdige chemische stof. Het kan worden gebruikt voor alledaagse doeleinden zoals het reinigen van verstopte afvoeren. Verschillende handelsbereidingen bevatten hiervoor natriumhydroxide. Het heeft ook een aantal toepassingen op het gebied van voedselverwerking., Ijs wordt verdikt met NaOH. Als olijven worden gedrenkt in een oplossing die natriumhydroxide en andere chemicaliën bevat, worden de olijven zwart. Zachte pretzels worden taai gemaakt door het aanbrengen van natriumhydroxide op het voedsel. Deze verbinding is op grote schaal gebruikt in de synthese van kunststoffen, voor het etsen van aluminium, voor verfverwijdering, en wordt gebruikt bij het onthoornen van runderen (in het geval dat u nodig hebt).
Arrhenius-basen
een Arrhenius− base is een verbinding die ioniseert tot hydroxideionen (OH -) in waterige oplossing., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., Bij het oplossen in water, elk dissocieert in een metaalkation en het hydroxide-ion.
![]()
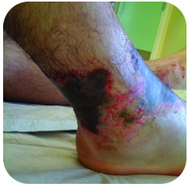
Figuur 2. Deze voet heeft ernstige brandwonden als gevolg van langdurig contact met een oplossing van natriumhydroxide, ook bekend als loog.
natriumhydroxide is een zeer bijtende stof, ook bekend als loog. Loog wordt gebruikt als een rigoureuze reiniger en is een ingrediënt in de vervaardiging van zeep. Voorzichtigheid is geboden met sterke basen zoals natriumhydroxide, aangezien blootstelling tot ernstige brandwonden kan leiden (zie Figuur 2 ).,
natrium behoort tot de groep elementen die alkalimetalen worden genoemd. Een alkalische oplossing is een andere naam voor een oplossing die basisch is. Alle alkalimetalen reageren gemakkelijk met water om het metaalhydroxide en waterstofgas te produceren. De daaruit voortvloeiende oplossingen zijn fundamenteel.
basen die bestaan uit een alkalimetaalkation en het hydroxide-anion zijn alle zeer goed oplosbaar in water. Verbindingen van de groep 2 metalen (de aardalkalimetalen) zijn ook basisch. Echter, deze verbindingen zijn over het algemeen niet zo oplosbaar in water., Daarom worden de dissociatiereacties voor deze verbindingen getoond als evenwichtsreacties.
deze relatief onoplosbare hydroxiden waren enkele van de verbindingen die werden besproken in de context van de oplosbaarheidsproductconstante ![]() . De oplosbaarheid van magnesiumhydroxide is 0,0084 g per liter water bij 25°C. Door zijn lage oplosbaarheid is magnesiumhydroxide niet zo gevaarlijk als natriumhydroxide., In feite is magnesiumhydroxide het actieve ingrediënt in een product genaamd magnesia-melk, dat wordt gebruikt als antacidum of een mild laxeermiddel.
. De oplosbaarheid van magnesiumhydroxide is 0,0084 g per liter water bij 25°C. Door zijn lage oplosbaarheid is magnesiumhydroxide niet zo gevaarlijk als natriumhydroxide., In feite is magnesiumhydroxide het actieve ingrediënt in een product genaamd magnesia-melk, dat wordt gebruikt als antacidum of een mild laxeermiddel.
samenvatting
- Arrhenius-zuur is gedefinieerd.
- voorbeelden van Arrhenius-zuren worden gegeven.
- Arrhenius-basis is gedefinieerd.
- voorbeelden van Arrhenius-bases worden gegeven.
praktijk
Lees het materiaal op de link hieronder en Beantwoord de volgende vragen:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- Wat was Arrhenius’ eerste wetenschappelijke idee?wat vond zijn Ph. D Commissie ervan?,
- Wat won hij voor dit idee?
- schrijf de generieke vergelijking voor dissociatie van een Arrhenius-zuur.
Review
Arrhenius-zuren
- Wat is een Arrhenius-zuur?
- Wat is een hydroniumion?
- Is H2SO4 een monoprotisch of polyprotisch zuur?
Arrhenius-Bases
- Wat is een Arrhenius-bases?
- Wat is een reactie die een Arrhenius-basis zal vormen?
- zijn basen van alkalische aarde zeer goed oplosbaar in water?
Leave a Reply