relatieve zuurgraad en pKa-waarden
een toepassing van de vergelijking Henderson-Hasselbach is het vermogen om de relatieve zuurgraad van verbindingen te bepalen door hun pKa-waarden te vergelijken. Hoe sterker een zuur, hoe groter de ionisatie, hoe lager de pKa, en hoe lager de pH de verbinding zal produceren in oplossing. Sommige geselecteerde PKA-waarden voor samenstellingen in de studie van organische chemie worden hieronder getoond., Aangezien organische reacties in niet-waterige omgevingen kunnen worden uitgevoerd, kan de pH 14 overschrijden en kunnen organische verbindingen pKa-waarden boven 16 hebben. Het is een variatie op die regel van The Wizard of Oz, “We don’ t live in water anymore.”





Het is een goed idee om zich te committeren aan het geheugen van de geschatte pKa bereiken van de verbindingen boven., Een woord van waarschuwing: wanneer u de pKa tabel gebruikt, moet u er absoluut zeker van zijn dat u het juiste geconjugeerde zuur/base paar overweegt. Als u wordt gevraagd om iets te zeggen over de basiciteit van ammoniak (NH3) in vergelijking met die van ethoxyde ion (CH3CH2O-), bijvoorbeeld, de relevante PKA waarden te overwegen zijn 9.2 (de pKa van ammoniumion) en 16 (de pKa van ethanol). Uit deze getallen Weet je dat ethoxyde de sterkere base is. Maak niet de fout om de pKa-waarde van 38 te gebruiken: dit is de pKa van ammoniak die werkt als een zuur, en vertelt je hoe basisch het NH2-ion is (heel basisch!,)
* een opmerking over de pKa van water: de pKa van water is 14. Biochemie en organische chemie teksten vermelden vaak de waarde als 15.7. Deze teksten hebben ten onrechte de molaire waarde voor de concentratie van water in de evenwichtsconstante berekend. De juiste afleiding van de evenwichtsconstante impliceert de activiteit van water, die een waarde van 1 heeft.
voorbeeld
hoewel deze cursus begint met enkele functionele groepen, zullen we uiteindelijk werken met interessante verbindingen die meerdere functionele groepen bevatten., Herkennen welke waterstof als zure protonen geïoniseerd kan worden en welke waterstof niet, is een nuttige vaardigheid. Merk in dit voorbeeld op dat we de potentiële zuurgraad op vier verschillende locaties op het molecuul moeten evalueren.
Aldehyde en aromatische protonen zijn helemaal niet zuur (pKavalues zijn boven de 40 – niet op onze tabel). De twee protonen op de koolstof naast de carbonyl zijn licht zuur, met pKa waarden rond 19-20 volgens de tabel., Het meest zure proton zit in de fenolgroep, dus als de verbinding zou worden onderworpen aan een enkele Molaire equivalent van sterke base, Dit is het proton dat zou worden gedoneerd.
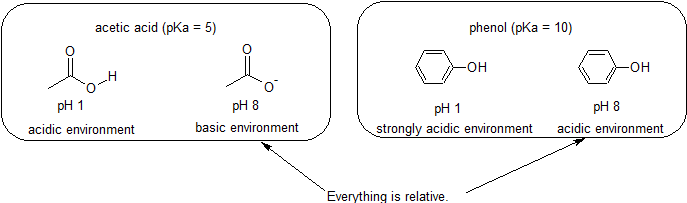
zuur & Basisomgevingen – alles is relatief in reactiviteit
omdat ons doel is het begrijpen van dynamische chemische reactiviteit, hoeven we niet de specifieke hoeveelheid geprotoneerde en niet-stationaire vormen van een verbinding te weten. We moeten gewoon weten welke vorm overheerst., Wanneer de pH van het milieu lager is dan de pKa van de verbinding, wordt het milieu als zuur beschouwd en zal de verbinding hoofdzakelijk in zijn geprotoneerde vorm bestaan. Wanneer de pH van het milieu groter is dan de pKa van de verbinding, wordt het milieu als basisch beschouwd en zal de verbinding hoofdzakelijk in zijn gedeprotoneerde vorm bestaan.
bijvoorbeeld, de pKa van azijnzuur is ongeveer 5. Bij een pH van 1 wordt het milieu als zuur beschouwd en bestaat azijnzuur voornamelijk in zijn geprotoneerde vorm., Bij pH 8 wordt het milieu als basisch beschouwd en wordt azijnzuur gedeprotoneerd tot acetaat (CH3CO2-). Omgekeerd is de pKa van fenol 10. Bij pH 8 wordt het milieu als zuur beschouwd voor fenol en blijft het voornamelijk geprotoneerd.
Het is ook belangrijk om te onthouden dat organische chemie niet hoeft te voorkomen in water, zodat pKa-waarden kunnen oplopen tot 50.
oefening
1. Vul de onderstaande tabel in om aan te geven of elke verbinding voornamelijk bestaat in zijn geprotoneerde (zure omgeving) of gedeprotoneerde (basische omgeving) vorm.,
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.,d597″>












Leave a Reply