Der Kern eines Atoms ist von Elektronen umgeben, die Schalen oder Orbitale unterschiedlicher Energieniveaus einnehmen.
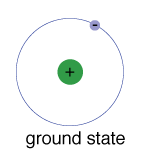
Der Grundzustand eines Elektrons, das Energieniveau, das es normalerweise einnimmt, ist der Zustand der niedrigsten Energie für dieses Elektron.
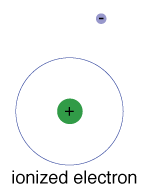
Es gibt auch eine maximale Energie, die jedes Elektron canhave und immer noch Teil seiner atom., Darüber hinaus ist das Elektron nicht mehr an den Kern des Atoms gebunden und gilt als ionisiert.
Wenn ein Elektron vorübergehend einen Energiezustand einnimmt, der größer als der Grundzustand ist, befindet es sich in einem angeregten Zustand. Ein Elektron kann angeregt werden, wenn es zusätzliche Energie erhält, z. B. wenn es ein Photon oder ein Paket von Licht absorbiert oder mit einem nahe gelegenen Atom oder Teilchen kollidiert.
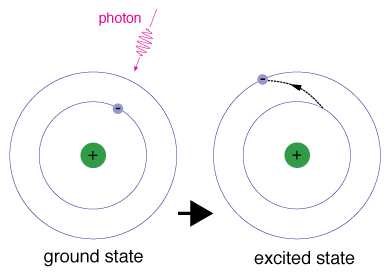
Jedem Orbital ist eine bestimmte Energie zugeordnet., Damit ein Elektron zu einem Orbital mit einer höheren Energie befördert wird, muss es die Energiedifferenz zwischen dem Orbital, in dem es sich befindet, und dem Orbital, zu dem es geht, übertreffen. Dies bedeutet, dass es ein Photon absorbieren muss, das genau diese Energiemenge enthält, oder genau diese Energiemenge von einem anderen Teilchen bei einer Kollision aufnehmen muss.
Elektronen bleiben nicht sehr lange in angeregten Zuständen – sie kehren bald zu ihren Grundzuständen zurück und emittieren ein Photon mit der gleichen Energie wie das absorbierte.,

Die Übergänge zwischen den verschiedenen Orbitalen sind für jedes Element eindeutig, da die Energieniveaus eindeutig von den Protonen und Neutronen im Kern bestimmt werden. Wenn die Elektronen eines bestimmten Atoms zurückkehrenum die Orbitale von angeregten Zuständen zu senken, haben die Photonen, die sie emittieren, Energien, die für diese Art von Atom charakteristisch sind. Dies gibt eachelement einen einzigartigen Fingerabdruck, so dass es möglich ist, dieelemente in einem Gasbehälter oder sogar einem Stern zu identifizieren.
Aktualisiert: November 2013
Leave a Reply