学習目標
- アレニウス酸を定義します。
- アレニウス酸の例を挙げる。
- ヒドロニウムイオンを記述します。
- アレニウス基底を定義します。
- アレニウスの基底の例を与える。li>
アレニウス酸
あまり深く呼吸しないでください。
 金星は私たちに最も近い惑星ですが、非常に異なる敵対的な環境を持っています。
金星は私たちに最も近い惑星ですが、非常に異なる敵対的な環境を持っています。
それは約450℃の平均表面温度を有する。, 大気は二酸化炭素で構成されていますが、硫酸の雲は上層大気を通って移動し、非常に非友好的な条件を作り出すのに役立ちます。 これらの条件のために、金星はあなたが休暇中に訪れたい場所ではありません。
Arrhenius Acids
スウェーデンの化学者Svante Arrhenius(1859-1927)は、酸と塩基の観察された挙動を説明する理論を最初に提案した。 電流を伝導する能力のために、彼は酸と塩基の両方が溶液中にイオンを含んでいることを知っていました。, アレニウス酸(Arrhenius acid)は、イオン化してaqueous液中で水素イオン(H+)を生成する化合物である。
酸は、イオン化可能な水素原子を有する分子化合物である。 高極性共有結合の一部である水素原子のみがイオン化可能である。 塩化水素(HCl)は、室温および常圧下のガスである。 塩化水素中のH-Cl結合は極性結合である。 水素原子は、塩素原子のより高い電気陰性度のために電子欠乏である。, その結果、HClが水に溶解されると、水素原子は水分子中の孤立電子対に引き寄せられる。 その結果、H-Cl結合が切断され、両方の結合電子がClに残り、塩化物イオンが形成される。 H+イオンは水分子に付着し、ヒドロニウムイオンと呼ばれる多原子イオンを形成する。 ヒドロニウムイオン(H3O+)は、水素イオンが結合した水分子と考えることができる。

図1. ヒドロニウムイオンの形成。,
水中の酸のイオン化を示す方程式は、水分子を省略することによってしばしば単純化される:
![]()
これは単に前の式の単純化であるが、一般的に使用されている。 Aqueous液中の任意の水素イオンは、ヒドロニウムイオンとして水分子に結合する。
 分子化合物中のすべての水素原子がイオン化可能ではありません。 メタン(CH4)では、水素原子はわずかに極性のみの結合で炭素と共有結合している。, 水素原子はイオン化することができず、メタンは酸性特性を有さない。 酢酸(CH3COOH)は有機酸と呼ばれる酸のクラスに属します。 分子内には四つの水素原子がありますが、酸素原子に結合している唯一の水素はイオン化可能です。O-H結合をイオン化してH+イオンおよび酢酸イオンを生成することができる。 この分子中の他の水素原子は酸性ではない。,e common acids:
分子化合物中のすべての水素原子がイオン化可能ではありません。 メタン(CH4)では、水素原子はわずかに極性のみの結合で炭素と共有結合している。, 水素原子はイオン化することができず、メタンは酸性特性を有さない。 酢酸(CH3COOH)は有機酸と呼ばれる酸のクラスに属します。 分子内には四つの水素原子がありますが、酸素原子に結合している唯一の水素はイオン化可能です。O-H結合をイオン化してH+イオンおよび酢酸イオンを生成することができる。 この分子中の他の水素原子は酸性ではない。,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., 塩酸および酢酸はモノタンパク酸である。 ポリプロトン酸は、複数のイオン化可能な水素を含む酸である。 ほとんどの一般的なポリプロトン酸は、二プロトン酸(H2SO4など)または三プロトン酸(H3PO4など)のいずれかである。
Arrhenius Bases
これは何に使用できますか?

水酸化ナトリウムは多目的な化学薬品です。 それは詰らせた下水管をきれいにすることのような世俗的な目的に使用することができる。 複数の商業の準備を含む水酸化ナトリウムです。 それにまた食品加工分野でいくつかの適用があります。, アイスクリームは、より厚NaOHを用い. オリーブが水酸化ナトリウムおよび他の化学薬品を含んでいる解決で浸されれば、オリーブは黒く回ります。 ソフトプレッツェルは、食品に水酸化ナトリウムを塗布することによって歯ごたえがあります。 この化合物は、プラスチックの合成、アルミニウムのエッチング、塗料除去に広く使用されており、牛の除角に使用されています(それが必要な場合)。
アレニウス塩基
アレニウス塩基は、aqueous液中で水酸化物イオン(OH−)を生成するためにイオン化する化合物である。, The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., 水に溶解すると、それぞれが金属陽イオンと水酸化物イオンに解離する。
![]()
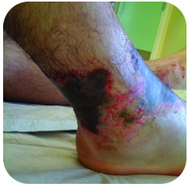
図2. この足は、アルカリ液としても知られている水酸化ナトリウムの溶液との長期間の接触による重度の火傷を有する。
水酸化ナトリウムは、灰汁としても知られている非常に腐食性の物質です。 アルカリ液は厳密な洗剤として使用され、石鹸の製造における成分である。 暴露は重度のやけどを引き起こす可能性があるため、水酸化ナトリウムのような強塩基で注意する必要があります(図2参照)。,
ナトリウムはアルカリ金属と呼ばれる元素のグループに属します。 アルカリ性溶液は、基本的な溶液の別の名前です。 すべてのアルカリ金属は水と容易に反応して金属水酸化物および水素ガスを生成する。 結果として得られる解決策は基本的です。
アルカリ金属カチオンと水酸化物アニオンからなる塩基はすべて水に非常に可溶性である。 第2族金属(アルカリ土類金属)の化合物も塩基性である。 しかしながら、これらの化合物は、一般に水に可溶ではない。, したがって、これらの化合物の解離反応を平衡反応として示した。
これらの比較的不溶性水酸化物は、溶解性積定数![]() の文脈で議論された化合物のいくつかであった。 水酸化マグネシウムの溶解度は0.0084g/lの水で25℃であり、その溶解度が低いため、水酸化マグネシウムは水酸化ナトリウムほど危険ではない。, 実際、水酸化マグネシウムは、制酸剤または軽度の下剤として使用されるマグネシアの牛乳と呼ばれる製品の有効成分です。
の文脈で議論された化合物のいくつかであった。 水酸化マグネシウムの溶解度は0.0084g/lの水で25℃であり、その溶解度が低いため、水酸化マグネシウムは水酸化ナトリウムほど危険ではない。, 実際、水酸化マグネシウムは、制酸剤または軽度の下剤として使用されるマグネシアの牛乳と呼ばれる製品の有効成分です。
概要
- アレニウス酸が定義されています。
- アレニウス酸の例を示した。
- Arrhenius baseが定義されています。
- アレニウス基の例を示した。
練習
以下のリンクで資料を読んで、次の質問に答えてください:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- アレニウスの最初の科学的アイデアは何でしたか?
- 彼の博士委員会はそれについて何を考えましたか?,
- 彼はこのアイデアのために何を勝ちましたか?
- アレニウス酸の解離のための一般的な方程式を書いてください。
レビュー
アレニウス酸
- アレニウス酸とは何ですか?li>
- ヒドロニウムイオンとは何ですか?
- H2SO4はモノタンパク質またはポリプロトン酸ですか?
アレニウスベース
- アレニウスベースとは何ですか?
- アレニウス塩基を形成する反応とは何ですか?li>
- アルカリ土類塩基は非常に水溶性ですか?
Leave a Reply