Periodici tendenze
in Primo luogo, dobbiamo concentrarci sui singoli atomi, e pensare tendenze associate con la posizione di un elemento nella tavola periodica. Useremo come nostri primi modelli i composti organici semplici etano, metilammina e metanolo, ma i concetti si applicano ugualmente a biomolecole più complesse, come le catene laterali di alanina, lisina e serina.,
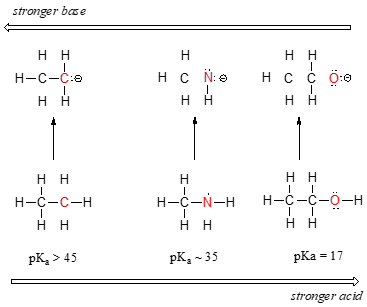
Possiamo vedere una chiara tendenza all’acidità mentre ci spostiamo da sinistra a destra lungo la seconda fila della tavola periodica dal carbonio all’azoto all’ossigeno. La chiave per comprendere questa tendenza è considerare l’ipotetica base coniugata in ciascun caso: più stabile (più debole) la base coniugata, più forte è l’acido. Guarda dove finisce la carica negativa in ogni base coniugata., Nell’anione etilico, la carica negativa è sostenuta dal carbonio, mentre nell’anione metilammina e nell’anione metossido le cariche si trovano rispettivamente su un azoto e un ossigeno. Ricorda la tendenza periodica dell’elettronegatività: aumenta anche man mano che ci spostiamo da sinistra a destra lungo una fila, il che significa che l’ossigeno è il più elettronegativo dei tre e il carbonio il minimo. Più un atomo è elettronegativo, meglio è in grado di sopportare una carica negativa., Pertanto, l’anione metossido è il più stabile (energia più bassa, meno base) delle tre basi coniugate e l’anione etilico è il meno stabile (energia più alta, più base).
Possiamo usare lo stesso insieme di idee per spiegare la differenza di basicità tra acqua e ammoniaca.
Osservando i valori pKavalues per gli acidi coniugati appropriati, sappiamo che l’ammoniaca è più basica dell’acqua. L’ossigeno, come l’elemento più elettronegativo, tiene più strettamente alla sua coppia solitaria rispetto all’azoto., La coppia solitaria di azoto, quindi, ha maggiori probabilità di staccarsi e formare un nuovo legame con un protone – è, in altre parole, più semplice. Ancora una volta, una base coniugata più reattiva (più forte) significa un acido coniugato meno reattivo (più debole).
Quando ci si sposta verticalmente all’interno di una data colonna della tavola periodica, osserviamo nuovamente una chiara tendenza periodica dell’acidità. Questo è meglio illustrato con gli alogenuri: la basicità, come l’elettronegatività, aumenta man mano che saliamo sulla colonna.,

Al contrario, l’acidità negli aloacidi aumenta man mano che ci spostiamo lungo la colonna.
Per dare un senso a questa tendenza, considereremo ancora una volta la stabilità delle basi coniugate. Poiché il fluoro è l’elemento alogeno più elettronegativo, potremmo aspettarci che il fluoro sia anche lo ion alogeno meno basico. Ma in realtà, è il meno stabile e il più elementare! Si scopre che quando si muove verticalmente nella tavola periodica, la dimensione dell’atomo supera la sua elettronegatività per quanto riguarda la basicità., Il raggio atomico di iodio è circa due volte quella di fluoro, in modo iodio ioni di litio, la carica negativa si sviluppa su una significativamente più grande del volume:

Questo illustra un concetto fondamentale in chimica organica, che è abbastanza importante da mettere in rosso:
cariche Elettrostatiche, siano essi positivi o negativi, sono più stabili quando sono ‘diffusi’, rispetto a quando sono limitato ad un solo atomo.,
Vedremo questa idea espressa più e più volte durante il nostro studio della reattività organica, in molti contesti diversi. Per ora, il concetto è applicato solo all’influenza del raggio atomico sulla stabilità dell’anione. Poiché il fluoruro è il meno stabile (più basico) delle basi coniugate alogenuri, l’HF è il meno acido degli aloacidi, solo leggermente più forte dell’acido acetico. CIAO, con un pKa di circa -9, è uno degli acidi più forti conosciuti.
Ancora più importante per lo studio della chimica organica biologica, questa tendenza ci dice che i tioli sono più acidi degli alcoli., Il pKa del gruppo tiolico sulla catena laterale della cisteina, ad esempio, è di circa 8,3, mentre il pKa per l’idrossl sulla catena laterale della serina è dell’ordine di 17.
Per ribadire: la forza acida aumenta man mano che ci spostiamo a destra lungo una riga della tavola periodica e mentre ci spostiamo lungo una colonna.
Disegnare la struttura della base coniugata che sarebbe se il composto al di sotto di reagire con 1 molare equivalente di idrossido di sodio:
Soluzione
L’effetto di risonanza
Nella sezione precedente abbiamo focalizzato la nostra attenzione su periodico tendenze – le differenze di acidità e basicità tra i gruppi di cui la intercambiabili protone è stato associato a diversi elementi., Ora, è il momento di pensare a come la struttura di diversi gruppi organici contribuisca alla loro relativa acidità o basicità, anche quando stiamo parlando dello stesso elemento che agisce come donatore/accettore di protoni. La prima coppia di modelli che considereremo è l’etanolo e l’acido acetico, ma le conclusioni che raggiungeremo saranno ugualmente valide per tutti i gruppi di alcol e acidi carbossilici.
Nonostante siano entrambi acidi di ossigeno, i valori pKa di etanolo e acido acetico sono molto diversi. Cosa rende un acido carbossilico molto più acido di un alcol?, Come prima, iniziamo considerando le basi coniugate.
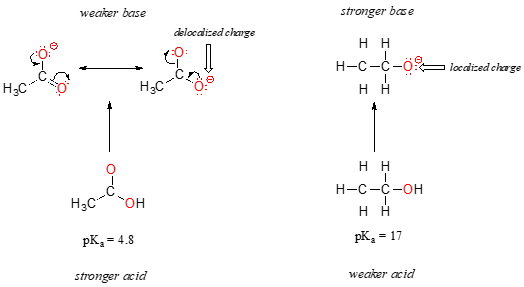
In entrambe le specie, la carica negativa sulla base coniugata è trattenuta da un ossigeno, quindi non è possibile invocare tendenze periodiche. Per l’acido acetico, tuttavia, c’è una differenza fondamentale: si può trarre un contributore di risonanza in cui la carica negativa è localizzata sul secondo ossigeno del gruppo. Le due forme di risonanza per la base coniugata sono uguali in energia, secondo le nostre “regole di risonanza”., Ciò significa, si può ricordare, che la carica negativa sullo acetate acetato non si trova su un ossigeno o l’altro: piuttosto è condivisa tra i due. I chimici usano il termine “delocalizzazione della carica” per descrivere questa situazione. Nello eth etossido, al contrario, la carica negativa è “bloccata” sul singolo ossigeno – non ha nessun altro posto dove andare.,
Ora è il momento di ripensare a quell’affermazione della sezione precedente che era così importante che è stata stampata in grassetto nel proprio paragrafo – in effetti, è così importante che lo ripeteremo: “Le cariche elettrostatiche, sia positive che negative, sono più stabili quando sono “distribuite” rispetto a quando sono confinate in un atomo.”Ora, stiamo vedendo questo concetto in un altro contesto, in cui una carica viene “distribuita” (in altre parole, delocalizzata) dalla risonanza, piuttosto che semplicemente dalla dimensione dell’atomo coinvolto.,
La delocalizzazione della carica per risonanza ha un effetto molto potente sulla reattività delle molecole organiche, sufficiente a spiegare la differenza di oltre 12 unità pKa tra etanolo e acido acetico (e ricorda, pKa è un’espressione di log, quindi stiamo parlando di una differenza di oltre 1012 tra le costanti di acidità per le due molecole). Lo acetate acetato è molto più stabile dello ion etossido, tutto a causa degli effetti della delocalizzazione della risonanza.,
L’effetto di risonanza spiega anche bene perché un atomo di azoto è fondamentale quando è in un’ammina, ma non fondamentale quando fa parte di un gruppo ammidico. Ricordiamo che in un’ammide, c’è un significativo carattere di doppio legame al legame carbonio-azoto, a causa di un secondo contributore di risonanza in cui la coppia solitaria di azoto fa parte di un legame P.
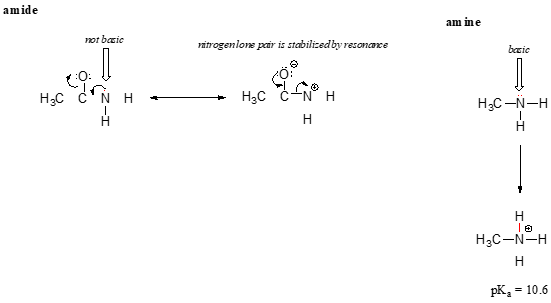
Mentre la coppia solitaria di elettroni di un azoto amminico è ‘bloccata’ in un punto, la coppia solitaria di un azoto ammidico viene delocalizzata per risonanza., Si noti che in questo caso, stiamo estendendo la nostra affermazione centrale per dire che la densità elettronica – sotto forma di una coppia solitaria – è stabilizzata dalla delocalizzazione della risonanza, anche se non è coinvolta una carica negativa. Ecco un altro modo di pensarci: la coppia solitaria su un azoto ammidico non è disponibile per il legame con un protone – questi due elettroni sono troppo “comodi” facendo parte del sistema di legame pi delocalizzato. La coppia solitaria su un azoto amminico, al contrario, non fa parte di un sistema p delocalizzato ed è molto pronta a formare un legame con qualsiasi protone acido che potrebbe essere nelle vicinanze.,
Spesso richiede un’attenta riflessione per prevedere il protone più acido su una molecola. L’acido ascorbico, noto anche come vitamina C, ha un pKa di 4.1.
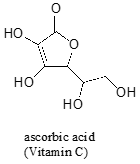
Ci sono quattro gruppi idrossilici su questa molecola – quale è il più acido? Se consideriamo tutte e quattro le possibili basi coniugate, scopriamo che ce n’è solo una per la quale possiamo delocalizzare la carica negativa su due atomi di ossigeno.
Classifica i composti sottostanti da più acidi a meno acidi e spiega il tuo ragionamento.,c3a3fdb788″>
Soluzione
L’effetto induttivo
Confrontare i valori di pKa dell’acido acetico e delle sue mono-, di-e tri-derivati clorurati:
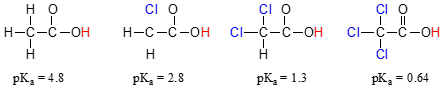
La presenza del chlorines chiaramente aumenta l’acidità dell’acido carbossilico gruppo, ma il discorso qui non hanno a che fare con la risonanza delocalizzazione, perché nessun ulteriore risonanza collaboratori può essere disegnato per il cloro molecole., Piuttosto, la spiegazione di questo fenomeno coinvolge qualcosa chiamato effetto induttivo. Un atomo di cloro è più elettronegativo di un idrogeno, e quindi è in grado di “indurre”, o “tirare” la densità elettronica verso se stesso, lontano dal gruppo carbossilato. In effetti, gli atomi di cloro stanno aiutando a diffondere ulteriormente la densità elettronica della base coniugata, che come sappiamo ha un effetto stabilizzante. In questo contesto, il sostituente del cloro è chiamato un gruppo di ritiro degli elettroni., Si noti che l’effetto di abbassamento del pKa di ciascun atomo di cloro, sebbene significativo, non è così drammatico come l’effetto di risonanza delocalizzante illustrato dalla differenza nei valori di pKa tra un alcol e un acido carbossilico. In generale, gli effetti di risonanza sono più potenti degli effetti induttivi.
L’effetto induttivo di ritiro degli elettroni dei clorini avviene attraverso legami covalenti e la sua influenza diminuisce notevolmente con la distanza-quindi un cloro a due carboni da un gruppo acido carbossilico ha un effetto diminuito rispetto a un cloro a un solo carbonio.
Leave a Reply