tendances périodiques
tout d’abord, nous allons nous concentrer sur les atomes individuels et réfléchir aux tendances associées à la position Nous utiliserons comme premiers modèles les composés organiques simples éthane, méthylamine et méthanol, mais les concepts s’appliquent également à des biomolécules plus complexes, telles que les chaînes latérales de l’alanine, de la lysine et de la sérine.,
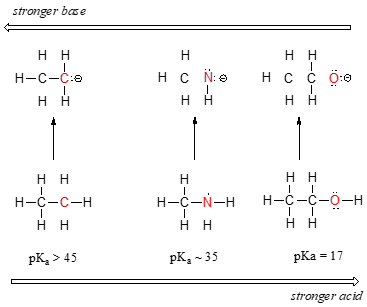
On peut voir une nette tendance à l’acidité comme nous déplacer de gauche à droite le long de la deuxième ligne du tableau périodique, de carbone, d’azote, d’oxygène. La clé pour comprendre cette tendance est de considérer la base conjuguée hypothétique dans chaque cas: plus la base conjuguée est stable (plus faible), plus l’acide est fort. Regardez où la charge négative se retrouve dans chaque base conjuguée., Dans l’anion éthyle, la charge négative est supportée par le carbone, tandis que dans l’anion méthylamine et l’anion méthoxyde, les charges sont situées respectivement sur un azote et un oxygène. Rappelez-vous la tendance périodique de l’électronégativité: elle augmente également lorsque nous passons de gauche à droite le long d’une rangée, ce qui signifie que l’oxygène est le plus électronégatif des trois, et le carbone le moins. Plus un atome est électronégatif, mieux il est capable de supporter une charge négative., Ainsi, l’anion méthoxyde est le plus stable (énergie la plus faible, moins basique) des trois bases conjuguées, et l’anion éthyle est le moins stable (énergie la plus élevée, plus basique).
Nous pouvons utiliser le même ensemble d’idées pour expliquer la différence de basicité entre l’eau et l’ammoniac.
En regardant les pKavalues pour les acides conjugués appropriés, nous savons que l’ammoniac est plus basique que l’eau. L’oxygène, en tant qu’élément le plus électronégatif, tient plus étroitement à sa paire solitaire que l’azote., La paire Solitaire d’azote est donc plus susceptible de se détacher et de former une nouvelle liaison avec un proton – elle est, en d’autres termes, plus basique. Encore une fois, une base conjuguée plus réactive (plus forte) signifie un acide conjugué moins réactif (plus faible).
en se déplaçant verticalement dans une colonne donnée du tableau périodique, nous observons à nouveau une nette tendance périodique de l’acidité. Ceci est mieux illustré avec les halogénures: la basicité, comme l’électronégativité, augmente à mesure que nous remontons la colonne.,

inversement, l’acidité dans les haloacides augmente à mesure que nous descendons la colonne.
afin de donner un sens à cette tendance, nous examinerons à nouveau la stabilité des bases conjuguées. Parce que le fluor est l’élément halogène le plus électronégatif, nous pourrions nous attendre à ce que le fluorure soit également l’ion halogène le moins basique. Mais en fait, c’est le moins stable, et la plus basique! Il s’avère que lors du déplacement vertical dans le tableau périodique, la taille de l’atome l’emporte sur son électronégativité en ce qui concerne la basicité., Le Rayon atomique de l’iode est environ deux fois celui du fluor, donc dans un ion iode, la charge négative est répartie sur un volume significativement plus grand:

ceci illustre un concept fondamental en chimie organique qui est suffisamment important pour être mis en rouge:
les charges électrostatiques, positives ou négatives, sont plus stables lorsqu’elles sont « étalées » que lorsqu’elles sont confinées à un atome.,
Nous verrons cette idée s’exprimer encore et encore tout au long de notre étude de la réactivité organique, dans de nombreux contextes différents. Pour l’instant, le concept est appliqué uniquement à l’influence du Rayon atomique sur la stabilité des anions. Parce que le fluorure est la moins stable (la plus basique) des bases conjuguées aux halogénures, HF est la moins acide des halogénoacides, seulement légèrement plus forte que l’acide acétique. Salut, avec un pKa d’environ -9, est l’un des acides les plus forts connus.
plus important encore pour l’étude de la chimie organique biologique, cette tendance nous indique que les thiols sont plus acides que les alcools., Le pKa du groupe thiol sur la chaîne latérale cystéine, par exemple, est d’environ 8,3, tandis que le pKa pour l’hydroxl sur la chaîne latérale sérine est de l’ordre de 17.
pour répéter: la force de l’acide augmente à mesure que nous nous déplaçons vers la droite le long d’une ligne du tableau périodique et que nous descendons une colonne.
dessinez la structure de la base conjuguée qui se formerait si le composé ci – dessous réagissait avec 1 équivalent molaire d’hydroxyde de sodium:
Solution
l’effet de résonance
dans la section précédente, nous avons concentré notre attention sur les tendances périodiques-les différences d’acidité et de basicité entre les groupes où le proton échangeable était lié à différents éléments., Maintenant, il est temps de réfléchir à la façon dont la structure des différents groupes organiques contribue à leur acidité relative ou à leur basicité, même lorsque nous parlons du même élément agissant comme donneur/accepteur de protons. La première paire de modèles que nous allons considérer est l’éthanol et l’acide acétique, mais les conclusions auxquelles nous parviendrons seront également valables pour tous les groupes alcool et acide carboxylique.
malgré le fait qu’ils soient tous deux des acides oxygénés, les valeurs de pKa de l’éthanol et de l’acide acétique sont très différentes. Qu’est-ce qui rend un acide carboxylique tellement plus acide qu’un alcool?, Comme précédemment, nous commençons par considérer les bases conjuguées.
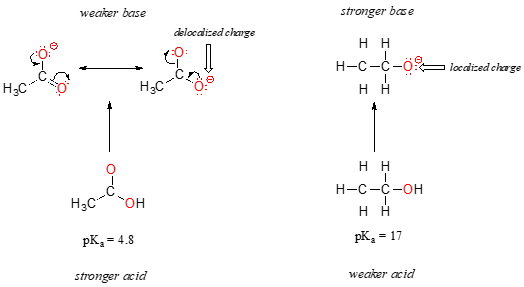
chez les deux espèces, la charge négative sur la base conjuguée est maintenue par un oxygène, de sorte que les tendances périodiques ne peuvent pas être invoquées. Pour l’acide acétique, cependant, il existe une différence clé: un contributeur de résonance peut être dessiné dans lequel la charge négative est localisée sur le deuxième oxygène du groupe. Les deux formes de résonance pour la base conjuguée sont égales en énergie, selon nos « règles de résonance »., Ce que cela signifie, vous vous souvenez peut-être, c’est que la charge négative sur l’ion acétate n’est pas située sur un oxygène ou l’autre: elle est plutôt partagée entre les deux. Les chimistes utilisent le terme « délocalisation de charge » pour décrire cette situation. Dans l’ion éthoxyde, en revanche, la charge négative est « verrouillée » sur l’oxygène unique – il n’a nulle part où aller.,
Il est maintenant temps de revenir à cette affirmation de la section précédente qui était si importante qu’elle a été imprimée en caractères gras dans son propre paragraphe – en fait, elle est si importante que nous le répéterons simplement: « les charges électrostatiques, positives ou négatives, sont plus stables lorsqu’elles sont « étalées » que lorsqu’elles sont confinées à un atome. »Maintenant, nous voyons ce concept dans un autre contexte, où une charge est ‘étaler’ (en d’autres termes, délocalisée), par résonance, plutôt que de simplement par la taille de l’atome impliqués.,
la délocalisation de la charge par résonance a un effet très puissant sur la réactivité des molécules organiques, assez pour expliquer la différence de plus de 12 unités de pKa entre l’éthanol et l’acide acétique (et rappelez-vous, pKa est une expression logarithmique, nous parlons donc d’une différence de plus de 1012 entre les constantes L’ion acétate est beaucoup plus stable que l’ion éthoxyde, tout cela en raison des effets de la délocalisation par résonance.,
L’effet de résonance aussi bien explique pourquoi un atome d’azote est de base quand il est dans une amine, mais pas quand il fait partie d’un groupe amide. Rappelons que dans un amide, il existe un caractère important de double liaison à la liaison carbone-azote, en raison d’un second contributeur de résonance dans lequel la paire Solitaire d’azote fait partie d’une liaison p.
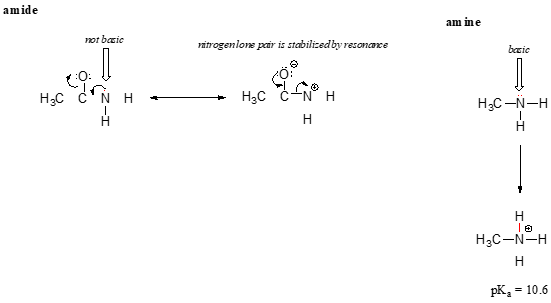
alors que la paire d’électrons isolés d’un azote amine est « bloquée » à un endroit, la paire isolée sur un azote amide est délocalisée par résonance., Notez que dans ce cas, nous étendons notre Énoncé central pour dire que la densité électronique – sous la forme d’une paire Solitaire – est stabilisée par délocalisation par résonance, même s’il n’y a pas de charge négative impliquée. Voici une autre façon de penser à ce sujet: la paire solitaire sur un azote amide n’est pas disponible pour la liaison avec un proton – ces deux électrons sont trop « à l’aise » de faire partie du système de liaison Pi délocalisé. La paire isolée sur un azote amine, en revanche, ne fait pas partie d’un système p délocalisé, et est très prête à former une liaison avec n’importe quel proton acide qui pourrait être à proximité.,
souvent, il faut une réflexion minutieuse pour prédire le proton le plus acide sur une molécule. L’acide ascorbique, également connu sous le nom de vitamine C, a un pKa de 4,1.
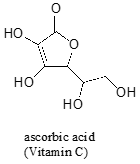
Il y a quatre groupes hydroxyles sur cette molécule qui est le plus acide? Si nous considérons les quatre bases conjuguées possibles, nous constatons qu’il n’y en a qu’une pour laquelle nous pouvons délocaliser la charge négative sur deux atomes d’oxygène.
Classez les composés ci-dessous du plus acide au moins acide, et expliquez votre raisonnement.,c3a3fdb788″>
Solution
L’effet inductif
Comparer les valeurs pKa de l’acide acétique et son mono-, di-et tri-dérivés chlorés:
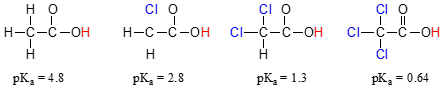
La présence de chlorures augmente nettement le taux d’acidité de l’acide carboxylique du groupe, mais l’argument ici n’a rien à voir avec la résonance de la délocalisation, car aucun autre résonance contributeurs peuvent être tirées pour les molécules chlorées., Au contraire, l’explication de ce phénomène implique quelque chose appelé l’effet inductif. Un atome de chlore est plus électronégatif qu’un hydrogène, et est donc capable d ‘ « induire », ou de « tirer » la densité électronique vers lui-même, loin du groupe carboxylate. En effet, les atomes de chlore contribuent à étendre davantage la densité électronique de la base conjuguée, ce qui, comme nous le savons, a un effet stabilisant. Dans ce contexte, le substituant du chlore est appelé groupe de retrait d’électrons., Notez que l’effet abaisseur de pKa de chaque atome de chlore, bien que significatif, n’est pas aussi dramatique que l’effet de résonance délocalisante illustré par la différence de valeurs de pKa entre un alcool et un acide carboxylique. En général, les effets de résonance sont plus puissants que les effets inductifs.
L’effet inductif de retrait d’électrons des chlorures se produit par des liaisons covalentes, et son influence diminue nettement avec la distance-ainsi un chlore à deux carbones d’un groupe acide carboxylique a un effet diminué par rapport à un chlore à un carbone.
Leave a Reply