Määräajoin suuntauksia
Ensinnäkin, me keskitymme yksittäisten atomien, ja miettiä trendejä, jotka liittyvät kanta elementin jaksollisen. Käytämme meidän ensimmäiset mallit yksinkertaisia orgaanisia yhdisteitä, etaani, metyyliamiini, ja metanolia, mutta käsitteet sovelletaan myös monimutkaisempia biomolekyylien, kuten puolella ketjut alaniini, lysiini, ja seriini.,
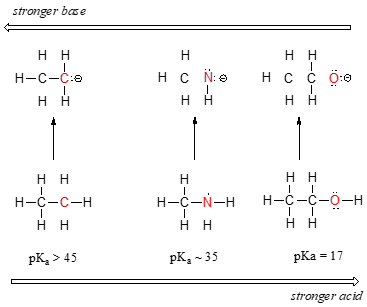
Voimme nähdä selkeä suuntaus happamuus, kun siirrytään vasemmalta oikealle pitkin toisen rivin jaksollisen alkaen hiili-typpi-happi. Avain ymmärtää tämä suuntaus on harkita hypoteettinen konjugaatti pohja kussakin tapauksessa: vakaampi (heikompi) konjugaatti pohja, vahvempi happo. Katso, mihin negatiivinen varaus päätyy kuhunkin konjugaattipohjaan., Vuonna etyyli-anioni negatiivinen maksu katetaan hiiltä, kun taas mono-anioni ja methoxide anioni maksut sijaitsevat typpi ja happi, vastaavasti. Muista säännöllinen trendi elektronegatiivisuus: se myös kasvaa, kun siirrytään vasemmalta oikealle pitkin peräkkäin, mikä tarkoittaa, että happea on kaikkein electronegative kolme, ja hiilen vähiten. Mitä elektronegatiivisempi atomi, sitä paremmin se pystyy kantamaan negatiivista varausta., Näin ollen methoxide anioni on vakain (pienin energia, ainakin perus) kolme konjugaatti emäkset, ja etyyli-anioni on ainakin vakaa (korkein energia, alkeellisinta).
Voimme käyttää samoja ideoita selittää eron emäksisyys välillä vettä ja ammoniakkia.
katsomalla pKavalues sopiva konjugaatti happoja, me tiedämme, että ammoniakki on enemmän perus kuin vettä. Happi pitää elektronegatiivisempana elementtinä tiukemmin kiinni yksinäisestä paristaan kuin typpi., Typen yksinäinen pari siis todennäköisemmin irtautuu ja muodostaa uuden sidoksen protoniin – se on toisin sanoen perustavampi. Jälleen reaktiivisempi (vahvempi) konjugaattiemäs tarkoittaa vähemmän reaktiivista (heikompaa) konjugaattihappoa.
Kun liikkuu pystysuunnassa tietyn sarakkeen jaksollisen, me taas todeta selvää määräajoin trendi happamuus. Tämä käy parhaiten ilmi halideista: basisiteetti, kuten elektronegatiivisuus, kasvaa, kun siirrymme pylvästä ylöspäin.,

Toisaalta, happamuutta haloacids kasvaa, kun siirrymme alas sarake.
jotta tämä suuntaus olisi järkevä, tarkastelemme jälleen konjugaattiemästen vakautta. Koska fluori on kaikkein electronegative halogeeni-elementti, voimme odottaa fluoria myös ainakin perus halogeeni-ioni. Mutta itse asiassa, se on vähiten vakaa,ja kaikkein perus! On käynyt ilmi, että kun liikkuu pystysuunnassa jaksollisen, koko atomin valttina sen elektronegatiivisuus osalta emäksisyys., Atomic säde jodi on noin kaksi kertaa, että fluoria, joten jodi-ionien negatiivinen varaus on hajallaan merkittävästi suurempi tilavuus:

Tämä osoittaa keskeinen käsite, orgaanisen kemian, joka on tarpeeksi tärkeä, laittaa punainen:
Sähköstaattisten, onko positiivinen tai negatiivinen, ovat vakaampia, kun he ovat ’levittää’ kuin silloin, kun ne ovat vain yhden atomin.,
näemme tämän ajatuksen yhä uudelleen orgaanisen reaktiivisuuden tutkimisen aikana monissa eri yhteyksissä. Toistaiseksi käsitettä sovelletaan vain atomisäteen vaikutukseen anioninvakauteen. Koska fluoridi on halidikonjugaattiemästen vähiten stabiili (alkeellisin), HF on haloasideista vähiten hapan, vain hieman etikkahappoa voimakkaampi. HI, jonka pKa on noin -9, on yksi vahvimmista tunnetuista hapoista.
biologista orgaanista kemiaa tutkittaessa tämä suuntaus kertoo tiolien olevan happamampia kuin Alkoholit., PKa, että tioli-ryhmän kysteiini puolella ketju, esimerkiksi, on noin 8,3, kun pKa varten hydroxl on seriini puolella ketju on järjestyksessä 17.
toistaa: hapon voimakkuus kasvaa, kun me siirtyä oikealle pitkin rivin jaksollisen, ja kun siirrymme alas sarake.
Piirrä rakenne konjugaatti pohja, joka olisi lomake, jos yhdiste alla olivat reagoida 1 molaarinen vastaa natriumhydroksidi:
Ratkaisu
resonanssi vaikutus
edellisessä jaksossa olemme keskittäneet huomiota määräajoin suuntauksia – erot happamuus ja emäksisyys ryhmien välillä, jossa vaihdettavat proton oli sidottu eri elementtejä., Nyt, se on aika miettiä, miten rakenne eri orgaanisten ryhmien edistää niiden suhteellinen happamuus tai emäksisyys, vaikka puhumme sama elementti toimii protonin luovuttajan/vastaanottajan. Ensimmäinen malli pari harkitsemme on etanolia ja etikkahappoa, mutta päätelmät pääsemme tulee olla yhtä päteviä kaikki alkoholi ja karboksyylihappo ryhmiä.
Huolimatta siitä, että ne ovat molemmat happea happojen pKa-arvot etanoli ja etikkahappo ovat hyvin erilaisia. Mikä tekee karboksyylihaposta niin paljon happamamman kuin alkoholista?, Kuten ennenkin, aloitamme tarkastelemalla konjugaattiemäksiä.
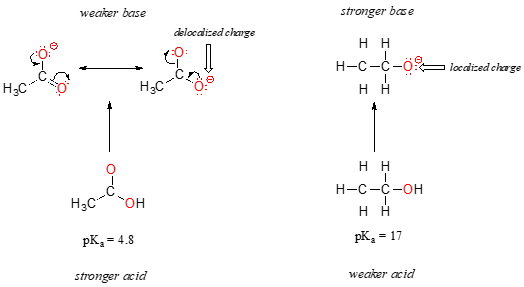
molemmat lajit, negatiivinen varaus on konjugaatti pohja on hallussa happea, joten määräajoin suuntauksia ei voida vedota. Etikkahapon kohdalla on kuitenkin keskeinen ero: voidaan vetää resonanssivaikuttaja, jossa negatiivinen varaus paikallistetaan ryhmän toiseen Happeen. Kaksi resonanssi lomakkeet konjugaatti pohja ovat yhtä suuret energian, mukaan meidän ’sääntöjä resonanssi’., Tämä tarkoittaa, saatat muistaa, että asetaatti-ionin negatiivinen varaus ei sijaitse yhdellä hapella tai toisella, vaan se jaetaan näiden kahden kesken. Kemistit käyttävät tätä tilannetta kuvaillessaan termiä ”veloituksen delokalisaatio”. Etoksidi-ionissa sen sijaan negatiivinen varaus on ”lukittu” yksittäiseen Happeen – sillä ei ole muuta paikkaa minne mennä.,
Nyt on aika muistella, että lausunnon edellisessä jaksossa, että oli niin tärkeää, että se on painettu lihavoiduin omalla kohta – itse asiassa, se on niin tärkeää, että me sanon sen taas: ”Sähköstaattisten, onko positiivinen tai negatiivinen, ovat vakaampia, kun he ovat ’levittää’ kuin silloin, kun ne ovat vain yhden atomin.”Nyt, me näemme tämän käsitteen muussa yhteydessä, missä maksu on ’levittää’ (toisin sanoen, delokalisoituneita) mukaan resonanssi, eikä vain koko atomin mukana.,
ala siirtyy muualle kuluja resonanssi on erittäin voimakas vaikutus reaktiivisuus, orgaanisten molekyylien, tarpeeksi huomioon eroa yli 12 pKa-yksikköä välillä etanoli ja etikkahappo (ja muista, pKa on lokin ilme, niin puhumme ero yli 1012 välillä happamuus vakiot kaksi molekyylejä). Asetaatti-ioni on niin paljon stabiilimpi kuin etoksidi-ioni, kaikki resonanssidelokalisaation vaikutuksesta.,
resonanssi vaikutus myös hienosti selittää, miksi on typpi-atomi on perus, kun se on amiini, mutta ei perus, kun se on osa amidi-ryhmän. Muistan, että amidi on merkittävä double-side merkin hiili-typpi-sidos, koska toinen resonanssi rahoittaja jossa typen lone-pair on osa s bond.
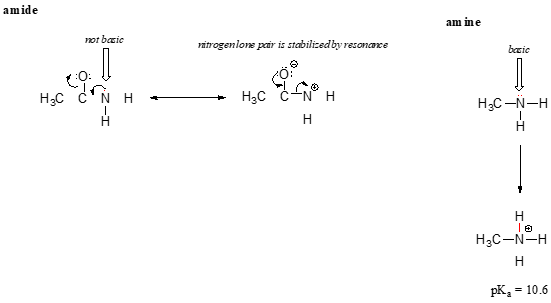
Kun elektroni yksinäinen pari on amiini typpi on ”jumissa” yksi paikka, yksinäinen pari on amidi typpi on delokalisoituneita, jonka resonanssi., Huomaa, että tässä tapauksessa, laajennamme keski-lausunto sanoa, että elektroni tiheys – muodossa lone – pair- on vakiintunut resonanssi ala siirtyy muualle, vaikka siellä ei ole negatiivinen lataus mukana. Tässä on toinen tapa ajatella sitä: lone-pair on amidi-typpeä ei ole saatavilla liimaus protoni – nämä kaksi elektronia ovat liian ”mukava” on osa delokalisoituneita pi-liimaus-järjestelmä. Amiinitypen yksinäinen pari sen sijaan ei kuulu delokalisoituneeseen p-järjestelmään, ja on hyvin valmis muodostamaan sidoksen minkä tahansa lähellä mahdollisesti olevan happaman protonin kanssa.,
usein molekyylin happamimman protonin ennustaminen vaatii huolellista harkintaa. Askorbiinihapon, joka tunnetaan myös C-vitamiinina, pKa on 4,1.
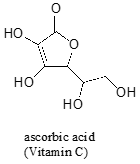
On olemassa neljä hydroksyyliryhmien tämä molekyyli – joista yksi on kaikkein hapan? Jos pidämme kaikki neljä mahdollista konjugaatti emäkset, huomaamme, että on vain yksi, jolle voimme delokalisoituneita negatiivinen varaus yli kaksi happiatomia.
Sijoitus yhdisteet alla kaikkein hapan vähiten hapan, ja selittää perustelut.,c3a3fdb788″>
Ratkaisu
induktiivinen vaikutus
Vertaa pKa-arvot etikkahappo ja sen mono-, di-, ja tri-kloorijohdannaiset:
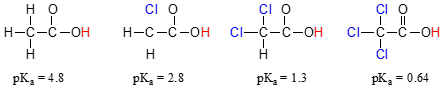
läsnäolo chlorines selvästi lisää happamuutta karboksyylihappo ryhmä, mutta argumentti täällä ei ole tekemistä sen kanssa, resonanssi, että ala siirtyy muualle, koska ei ole muita resonanssi avustajat voidaan tehdä kloorattu molekyylejä., Sen sijaan tämän ilmiön selittämiseen liittyy jotakin niin sanottua induktiivista vaikutusta. Klooria atom on enemmän electronegative kuin vety, ja näin on mahdollisuus ’aiheuttaa’, tai ’vetää’ elektroni tiheys kohti itse, pois karboksylaatti-ryhmä. Itse asiassa, klooria atomien auttavat edelleen levittää electron tiheys konjugaatti pohja, joka, kuten tiedämme, on vakauttava vaikutus. Tässä yhteydessä klooria substituentin kutsutaan elektroni-ryhmän vetäminen., Huomaa, että pKa-arvoja alentava vaikutus kunkin klooria atom, kun taas merkittävä, ei ole niin dramaattinen kuin delocalizing resonanssi vaikutus havainnollistaa ero pKa-arvot välillä alkoholi ja karboksyylihappo. Yleensä resonanssivaikutukset ovat induktiivisia vaikutuksia voimakkaampia.
induktiivinen electron-peruuttamista vaikutus chlorines tapahtuu kovalenttisten joukkovelkakirjojen, ja sen vaikutus pienenee selvästi etäisyyden – siis klooria kaksi hiiliatomia päässä karboksyylihappo-ryhmä on vähentynyt vaikutus verrattuna klooria vain yksi hiili pois.
Leave a Reply