objetivos de aprendizaje
- definen el ácido de Arrhenius.
- dar ejemplos de ácidos de Arrhenius.
- Describir el ion hidronio.
- Define Arrhenius base.
- dar ejemplos de bases de Arrhenius.
ácidos de Arrhenius
No respire demasiado profundamente.
 Venus es el planeta más cercano a nosotros, pero tiene un entorno muy diferente y hostil.
Venus es el planeta más cercano a nosotros, pero tiene un entorno muy diferente y hostil.
Tiene una temperatura superficial que promedia alrededor de 450°C., La atmósfera está compuesta de dióxido de carbono, pero las nubes de ácido sulfúrico se mueven a través de la atmósfera superior, ayudando a crear las condiciones extremadamente hostiles. Debido a estas Condiciones, Venus no es un lugar que desee visitar de vacaciones.
ácidos de Arrhenius
El químico sueco Svante Arrhenius (1859-1927) fue el PRIMERO en proponer una teoría para explicar el comportamiento observado de ácidos y bases. Debido a su capacidad para conducir una corriente, sabía que tanto los ácidos como las bases contenían iones en solución., Un ácido de Arrhenius es un compuesto, que ioniza para producir iones de hidrógeno (H + ) en solución acuosa.
Los ácidos son compuestos moleculares con átomos de hidrógeno ionizables. Solo los átomos de hidrógeno que forman parte de un enlace covalente altamente polar son ionizables. El cloruro de hidrógeno (HCl) es un gas a temperatura ambiente y bajo presión normal. El enlace H-Cl en el cloruro de hidrógeno es un enlace polar. El átomo de hidrógeno es deficiente en electrones debido a la mayor electronegatividad del átomo de cloro., En consecuencia, el átomo de hidrógeno es atraído por el par solitario de electrones en una molécula de agua cuando el HCl se disuelve en agua. El resultado es que el enlace H-Cl se rompe, con ambos electrones de enlace permaneciendo con el Cl, formando un ion cloruro. El ion H + se une a la molécula de agua, formando un ion poliatómico llamado ion hidronio. El ion hidronio (H 3 O+) puede ser considerado como una molécula de agua con un ion hidrógeno unido.

la Figura 1. Formación de un ion hidronio.,
Las ecuaciones que muestran la ionización de un ácido en el agua se simplifican frecuentemente omitiendo la molécula de agua:
![]()
esto es simplemente una simplificación de la ecuación anterior, pero se usa comúnmente. Cualquier iones de hidrógeno en una solución acuosa se unirá a las moléculas de agua como iones de hidronio.
 No todos los átomos de hidrógeno en compuestos moleculares son ionizables. En el metano (CH 4), los átomos de hidrógeno están unidos covalentemente al carbono en enlaces que son solo ligeramente polares., Los átomos de hidrógeno no son capaces de ionizarse y el metano no tiene propiedades ácidas. El ácido acético (CH 3 COOH) pertenece a una clase de ácidos llamados ácidos orgánicos. Hay cuatro átomos de hidrógeno en la molécula, pero solo el hidrógeno que está unido a un átomo de oxígeno es ionizable.
No todos los átomos de hidrógeno en compuestos moleculares son ionizables. En el metano (CH 4), los átomos de hidrógeno están unidos covalentemente al carbono en enlaces que son solo ligeramente polares., Los átomos de hidrógeno no son capaces de ionizarse y el metano no tiene propiedades ácidas. El ácido acético (CH 3 COOH) pertenece a una clase de ácidos llamados ácidos orgánicos. Hay cuatro átomos de hidrógeno en la molécula, pero solo el hidrógeno que está unido a un átomo de oxígeno es ionizable.
el enlace O-H se puede ionizar para producir el ion H + y el ion acetato. Los otros átomos de hidrógeno en esta molécula no son ácidos.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., El ácido clorhídrico y el ácido acético son ácidos monoproteicos. Un ácido poliprótico es un ácido que contiene múltiples hidrógenos ionizables. Los ácidos polipróticos más comunes son dipróticos (como H 2 SO 4 ) o tripróticos (como H 3 PO 4 ).
Arrhenius Bases
¿para qué se puede usar esto?

el hidróxido de Sodio es un versátil producto químico. Se puede utilizar para fines tan mundanos como la limpieza de desagües obstruidos. Varios preparados comerciales contienen hidróxido de sodio para este propósito. También tiene una serie de aplicaciones en el campo de procesamiento de alimentos., El helado se espesa usando NaOH. Si las aceitunas se empapan en una solución que contiene hidróxido de sodio y otros productos químicos, las aceitunas se volverán Negras. Los pretzels blandos se hacen masticables mediante la aplicación de hidróxido de sodio a los alimentos. Este compuesto ha sido ampliamente utilizado en la síntesis de plásticos, para el grabado de aluminio, para la eliminación de pintura, y se emplea en el descornado de ganado (en caso de que sea una necesidad que tenga).
bases de Arrhenius
una base de Arrhenius es un compuesto, que ioniza para producir iones hidróxido (OH− ) en solución acuosa., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., Al disolverse en agua, cada uno se disocia en un catión metálico y el ion hidróxido.
![]()
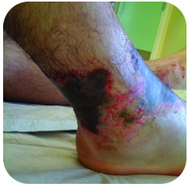
la Figura 2. Este pie tiene quemaduras graves debido al contacto prolongado con una solución de hidróxido de sodio, también conocida como lejía.
El hidróxido de sodio es una sustancia muy cáustica también conocida como lejía. La lejía se utiliza como un limpiador riguroso y es un ingrediente en la fabricación de jabones. Se debe tener cuidado con bases fuertes como el hidróxido de sodio, ya que la exposición puede conducir a quemaduras graves (ver Figura 2 ).,
El sodio pertenece al grupo de elementos llamados metales alcalinos. Una solución alcalina es otro nombre para una solución básica. Todos los metales alcalinos reaccionan fácilmente con el agua para producir el hidróxido metálico y el gas hidrógeno. Las soluciones resultantes son básicas.
Las Bases que consisten en un catión de metal alcalino y el anión hidróxido son todas muy solubles en agua. Los compuestos de los metales del Grupo 2 (los metales alcalinotérreos) también son básicos. Sin embargo, estos compuestos generalmente no son tan solubles en agua., Por lo tanto, las reacciones de disociación para estos compuestos se muestran como reacciones de equilibrio.
estos hidróxidos relativamente insolubles fueron algunos de los compuestos discutidos en el contexto de la constante del producto de solubilidad ![]() . La solubilidad del hidróxido de magnesio es de 0.0084 g por litro de agua a 25°C. Debido a su baja solubilidad, el hidróxido de magnesio no es tan peligroso como el hidróxido de sodio., De hecho, el hidróxido de magnesio es el ingrediente activo de un producto llamado leche de magnesia, que se usa como antiácido o laxante suave.
. La solubilidad del hidróxido de magnesio es de 0.0084 g por litro de agua a 25°C. Debido a su baja solubilidad, el hidróxido de magnesio no es tan peligroso como el hidróxido de sodio., De hecho, el hidróxido de magnesio es el ingrediente activo de un producto llamado leche de magnesia, que se usa como antiácido o laxante suave.
resumen
- Se define el ácido de Arrhenius.
- Se dan ejemplos de ácidos de Arrhenius.
- Arrhenius base está definido.
- Se dan ejemplos de bases de Arrhenius.
Practice
lea el material en el siguiente enlace y responda las siguientes preguntas:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- ¿Cuál fue la primera idea científica de Arrhenius?
- ¿Qué piensa su Comité de Doctorado al respecto?,
- ¿Qué ganó Por esta idea?
- escriba la ecuación genérica para la disociación de un ácido de Arrhenius.
Review
ácidos de Arrhenius
- ¿Qué es un ácido de Arrhenius?
- ¿Qué es un ion hidronio?
- ¿El H2SO4 es un ácido monoproteico o poliprótico?
Arrhenius Bases
- ¿Qué es una base Arrhenius?
- ¿Cuál es una reacción que formará una base de Arrhenius?
- ¿Las bases alcalinotérreas son muy solubles en agua?
Leave a Reply