Periodiske tendenser
for det Første, vil vi fokusere på de enkelte atomer, og tænk over tendenser, der er forbundet med placeringen af et element i det periodiske system. Vi bruger som vores første modeller de enkle organiske forbindelser Ethan, methylamin og methanol, men begreberne gælder ligeledes for mere komplekse biomolekyler, såsom sidekæderne af alanin, lysin og serin.,
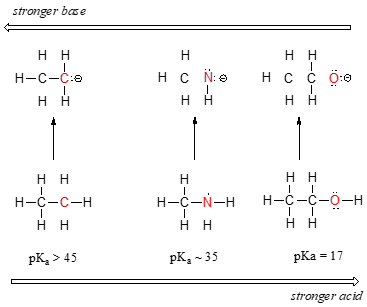
Vi kan se en klar tendens i surhedsgrad, når vi bevæger os fra venstre mod højre langs den anden række i det periodiske bord fra kulstof til nitrogen til ilt. Nøglen til at forstå denne tendens er at overveje den hypotetiske konjugatbase i hvert tilfælde: jo mere stabil (svagere) konjugatbasen er, desto stærkere er syren. Se på, hvor den negative ladning ender i hver konjugatbase., I ethylanionen bæres den negative ladning af kulstof, mens ladningerne i methylaminanionen og metho .idanionen er placeret på henholdsvis et nitrogen og et O .ygen. Husk periodisk trend i elektronegativiteten: det øger også når vi bevæger os fra venstre mod højre langs en række, hvilket betyder, at ilt er den mest elektronegative af de tre, og kulstof-mindst. Jo mere elektronegative et atom er, desto bedre er det i stand til at bære en negativ ladning., Således methoxide anion er den mest stabile (laveste energi, mindst basic) af de tre separate baser, og ethyl-anion er den mindst stabile (højeste energi, mest grundlæggende).
Vi kan bruge det samme sæt ideer til at forklare forskellen i basicitet mellem vand og ammoniak.
Ved at se på pkavaluerne for de passende konjugatsyrer ved vi, at ammoniak er mere basisk end vand. O .ygen, som det mere elektronegative element, holder tættere på sit ensomme par end nitrogenet., Det kvælstof-ensomme par er derfor mere tilbøjelige til at bryde væk og danne en ny binding til en proton – det er med andre ord mere grundlæggende. Endnu en gang betyder en mere reaktiv (stærkere) konjugatbase en mindre reaktiv (svagere) konjugatsyre.
Når vi bevæger os lodret inden for en given kolonne i det periodiske bord, observerer vi igen en klar periodisk tendens i surhed. Dette illustreres bedst med halogenider: basicitet, som elektronegativitet, stiger, når vi bevæger os op ad søjlen.,

omvendt øges surheden i haloaciderne, når vi bevæger os ned i kolonnen.
for at få mening ud af denne tendens vil vi igen overveje stabiliteten af de konjugerede baser. Fordi fluor er det mest elektronegative halogenelement, kan vi forvente, at fluor også er den mindst basale halogenion. Men det er faktisk den mindst stabile og den mest grundlæggende! Det viser sig, at når man bevæger sig lodret i det periodiske bord, overtrumfer atomets størrelse sin elektronegativitet med hensyn til basicitet., Atomets radius af jod er ca det dobbelte af fluor, så i en jod-ion, den negative ladning er spredt ud over et betydeligt større volumen:

Dette illustrerer et grundlæggende begreb i den organiske kemi, der er vigtigt nok til at sætte i rød:
Elektrostatiske ladninger, hvad enten de er positive eller negative, er mere stabile, når de bliver ‘spredt ud’, end når de er begrænset til et atom.,
Vi vil se denne ID.udtrykt igen og igen gennem vores undersøgelse af organisk reaktivitet i mange forskellige sammenhænge. For tiden anvendes konceptet kun på atomradiusens indflydelse på anionstabilitet. Fordi fluor er den mindst stabile (mest basale) af halogenidkonjugatbaserne, er HF den mindst SURE af haloaciderne, kun lidt stærkere end eddikesyre. Hej, med en pKa på omkring -9, er en af de stærkeste syrer kendt.
vigtigere for undersøgelsen af biologisk organisk kemi fortæller denne tendens os, at thioler er mere sure end alkoholer., PKa for thiol-gruppen på cysteinsidekæden er for eksempel cirka 8, 3, mens PKA for Hydro .l på serinsidekæden er i størrelsesordenen 17.
for at gentage: syrestyrken øges, når vi bevæger os til højre langs en række i det periodiske bord, og når vi bevæger os ned ad en kolonne.
Tegn strukturen af den konjugerede base, der ville danne, hvis de sammensatte nedenfor var til at reagere med 1 molær tilsvarende natriumhydroxid:
Løsningen
resonanseffekten
I forrige afsnit, vi fokuserer vores opmærksomhed på periodiske tendenser – forskelle i surhedsgrad og basicity mellem grupper, hvor de skiftes proton var bundet til forskellige elementer., Nu er det tid til at tænke over, hvordan strukturen i forskellige organiske grupper bidrager til deres relative surhed eller basicitet, selv når vi taler om det samme element, der fungerer som protondonoren/acceptoren. Det første modelpar, vi vil overveje, er ethanol og eddikesyre, men de konklusioner, vi når, vil være lige gyldige for alle alkohol-og Carbo .ylsyregrupper.
På trods af at de begge er iltsyrer, er PKA-værdierne af ethanol og eddikesyre meget forskellige. Hvad gør en Carbo ?ylsyre så meget mere sur end en alkohol?, Som før begynder vi med at overveje de konjugerede baser.
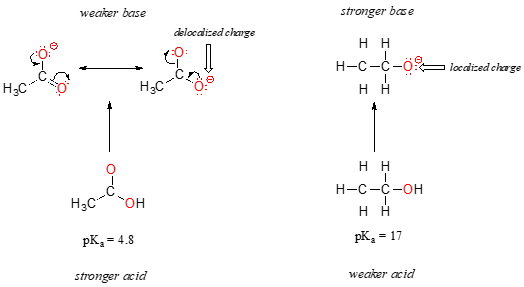
i begge arter holdes den negative ladning på den konjugerede base af et ilt, så periodiske tendenser kan ikke påberåbes. For eddikesyre er der imidlertid en nøgleforskel: en resonansbidrag kan trækkes, hvor den negative ladning er lokaliseret på gruppens andet ilt. De to resonansformer for den konjugerede base er ens i energi i henhold til vores ‘resonansregler’., Hvad dette betyder, husker du måske, er, at den negative ladning på acetation ikke er placeret på det ene ilt eller det andet: snarere deles det mellem de to. Kemikere bruger udtrykket ‘delokalisering af ladning’ til at beskrive denne situation. I Etho .idionen er derimod den negative ladning ‘låst’ på det enkelte ilt – det har intet andet sted at gå.,
Nu er det tid til at tænke tilbage til, at erklæring fra det foregående afsnit, der var så vigtigt, at det fik trykt i fed skrift i sin egen præmis – i virkeligheden, det er så vigtigt, at vi bare sige det igen: “Elektrostatiske ladninger, hvad enten de er positive eller negative, er mere stabile, når de bliver ‘spredt ud’, end når de er begrænset til et atom.”Nu ser vi dette koncept i en anden sammenhæng, hvor en afgift bliver “spredt ud” (med andre ord delokaliseret) af resonans, snarere end blot af størrelsen af det involverede atom.,
delocalization beregning af resonans har en meget kraftig virkning på reaktiviteten af organiske molekyler, nok til at redegøre for forskellen på over 12 pKa enheder mellem ethanol og eddikesyre (og husk, at pKa er en log udtryk, så taler vi om en forskel på over 1012 mellem syreindhold konstanter for de to molekyler). Acetat-ionen er så meget mere stabil end Etho .id-ionen, alt sammen på grund af virkningerne af resonansdelokalisering.,
resonanseffekten forklarer også pænt, hvorfor et nitrogenatom er grundlæggende, når det er i en amin, men ikke grundlæggende, når det er en del af en amidgruppe. Husk på, at i en amid, der er betydelig dobbelt-binding karakter til carbon-nitrogenbindingen, på grund af en anden resonans bidragyder, hvor nitrogen lone par er en del af en p-binding.
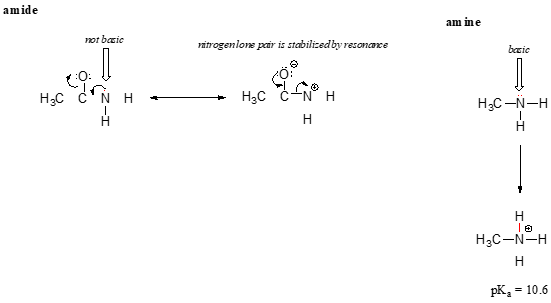
mens det elektron-ensomme par af et aminkvælstof ‘sidder fast’ et sted, delokaliseres det ensomme par på et amidkvælstof af resonans., Bemærk, at vi i dette tilfælde udvider vores centrale erklæring til at sige, at elektrondensitet – i form af et ensomt par – stabiliseres ved resonansdelokalisering, selvom der ikke er en negativ ladning involveret. Her er en anden måde at tænke på: det ensomme par på et amidkvælstof er ikke tilgængeligt til binding med en proton – disse to elektroner er for ‘behagelige’ at være en del af det delokaliserede pi-bindingssystem. Det ensomme par på et aminkvælstof er derimod ikke en del af et delokaliseret p-system og er meget klar til at danne en binding med enhver sur proton, der måtte være i nærheden.,
ofte kræver det en omhyggelig tanke at forudsige den mest sure proton på et molekyle. Ascorbinsyre, også kendt som C-Vitamin, har en PKA på 4,1.
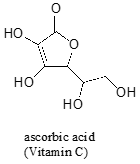
Der er fire hydroxylgrupper på dette molekyle – hvilken en der er mest sure? Hvis vi overvejer alle fire mulige konjugatbaser, finder vi, at der kun er en, som vi kan delokalisere den negative ladning over to iltatomer.eksempel 7.7
rang compoundsr forbindelserne nedenfor fra de fleste sure til mindst sure, og forklar din begrundelse.,c3a3fdb788″>
Løsningen
Den induktive effekt
Sammenlign pKa-værdier af eddikesyre og dens mono-, di-og tri-chlorderivater:
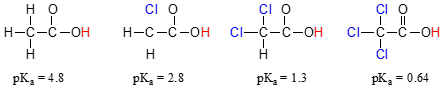
tilstedeværelsen af chlorines klart øger surhedsgraden af carboxylsyre-gruppe, men argumentet her ikke har at gøre med resonans delocalization, fordi ingen yderligere resonans bidragydere kan drages for de chlorerede molekyler., Forklaringen på dette fænomen involverer snarere noget, der kaldes den induktive effekt. Et kloratom er mere elektronegativt end et hydrogen og er således i stand til at ‘inducere’ eller ‘trække’ elektrondensitet mod sig selv væk fra Carbo .ylatgruppen. I virkeligheden hjælper kloratomerne med at sprede elektrondensiteten af den konjugerede base yderligere, som vi ved har en stabiliserende virkning. I denne sammenhæng kaldes chlorsubstituenten en elektronudvindende gruppe., Bemærk, at den PKA-sænkende virkning af hvert kloratom, mens det er signifikant, ikke er så dramatisk som den delokaliserende resonanseffekt illustreret af forskellen i pKa-værdier mellem en alkohol og en Carbo .ylsyre. Generelt er resonanseffekter mere kraftfulde end induktive effekter.
Den induktive elektron-fratagelse af effekten af chlorines finder sted gennem kovalente bindinger, og dens indflydelse aftager markant med afstanden – og dermed en klor to kulstofatomer væk fra en carboxylsyre-gruppe har en nedsat effekt i forhold til en klor bare en kulstof væk.
Leave a Reply