jádro atomu je obklopena elektrony, které zabírají skořápky, nebo orbitaly různé energetické hladiny.
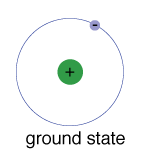
základní stav elektronu, úroveň energie, to normallyoccupies, je stav nejnižší energie pro elektron.
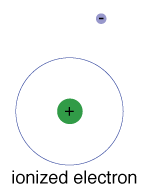
k Dispozici je také maximální energie, že každý elektron a mohou být stále součástí jeho atom., Kromě této energie již elektron není vázán na jádro atomu a je považován za ionizovaný.
když elektron dočasně zabírá energetický stav větší nežjeho stav země, je ve vzrušeném stavu. Elektron canbecome nadšený, pokud to je vzhledem extra energii, například pokud absorbuje foton, nebo paket, světla, nebo se srazí s nedaleké atom nebo částice.
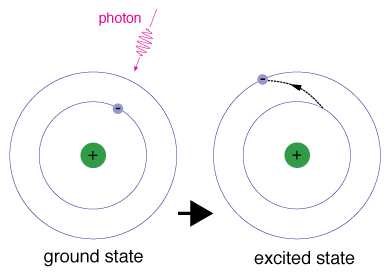
každý orbital má s ním spojenou specifickou energii., Pro elektronu být posílen na orbital s vyšší energií, je mustovercome rozdíl v energii mezi orbitální to je, a theorbital ke které se směřuje. To znamená, že musí absorbovat foton, který obsahuje přesně to množství energie, nebo přesně to, co je součástí energie z jiné částice při srážce.
Elektrony nemají zůstat v excitovaných stavů velmi dlouho – oni soonreturn jejich zem států, emitující foton se stejnou energií, jako ten, který byl absorbován.,

Přechody mezi různými orbitaly jsou jedinečné pro každý elementbecause energetické hladiny jsou jednoznačně určena protonů andneutrons v jádře. Když se elektrony určitého atomu vrátík nižším orbitálům z excitovaných stavů mají fotony, které vyzařují, vlastnosti tohoto druhu atomu. To dává každému z nich jedinečný otisk prstu, který umožňuje identifikovatprvky přítomné v nádobě s plynem nebo dokonce hvězdou.
Aktualizováno: listopad 2013
Leave a Reply