Relativní Kyselost a Hodnoty pKa
aplikace Henderson-Hasselbach Rovnice je schopnost určit relativní kyselost sloučeniny porovnáním jejich hodnoty pKa. Čím silnější je kyselina, tím větší je ionizace, tím nižší je pKa a čím nižší je pH, které sloučenina vytvoří v roztoku. Některé vybrané hodnoty pKa pro sloučeniny ve studiu organické chemie jsou uvedeny níže., Protože organické reakce mohou být prováděny v nevodném prostředí, pH může překročit 14 a organické sloučeniny mohou mít hodnoty pKa nad 16. Je to variace na této lince od Čaroděje ze země Oz, “ už Nežijeme ve vodě.“.“





To je velmi dobrý nápad, aby se zavázaly k paměti přibližné pKa se pohybuje sloučenin výše., Pozor: při použití tabulky pKa si buďte naprosto jisti, že uvažujete o správném páru kyseliny/báze konjugátu. Pokud jste požádáni, aby říct něco o basicity amoniaku (NH3) ve srovnání s ethoxide ion (CH3CH2O-), například, příslušné hodnoty pKa, aby zvážila, je 9.2 (pKa amonných iontů) a 16 (pKa ethanolu). Z těchto čísel víte, že ethoxid je silnější základna. Nedělejte chybu při použití hodnoty pKa 38: jedná se o pKa amoniaku působícího jako kyselina a řekne vám, jak základní je NH2 – ion (velmi základní!,)
* poznámka na pKa vody: pKa vody je 14. Texty biochemie a organické chemie často uvádějí hodnotu jako 15.7. Tyto texty nesprávně zohlednily molární hodnotu koncentrace vody do rovnovážné konstanty. Správné odvození rovnovážné konstanty Zahrnuje aktivitu vody, která má hodnotu 1.
příklad
zatímco tento kurz začíná jednotlivými funkčními skupinami, nakonec budeme pracovat se zajímavými sloučeninami obsahujícími více funkčních skupin., Rozpoznání, které vodíky mohou být ionizovány jako kyselé protony a které vodíky nemohou, je užitečná dovednost. Všimněte si v tomto příkladu, že musíme vyhodnotit potenciální kyselost na čtyřech různých místech na molekule.
aldehydové a aromatické protony nejsou vůbec kyselé (pKavalues jsou nad 40 – ne na našem stole). Dva protony na uhlíku vedle karbonylu jsou mírně kyselé, s hodnotami pKa kolem 19-20 podle tabulky., Nejvíce kyselý proton je na fenolové skupiny, takže pokud sloučeniny byly podrobeny jeden molární ekvivalent silnou základnu, to je proton, který by daroval.
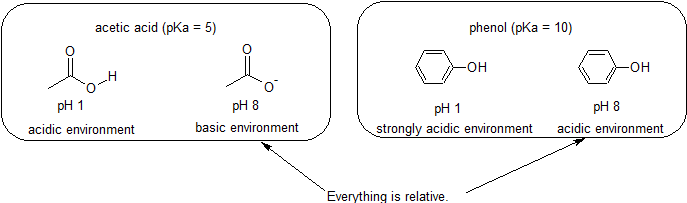
Kyselé & Základní Prostředí – Všechno je Relativní v Reaktivitu,
Protože naším cílem je pochopení dynamické chemická reaktivita, nepotřebujeme znát konkrétní výši protonované a unprotonated formy složené. Prostě musíme vědět, která forma převládá., Pokud je pH prostředí menší než pKa sloučeniny, je prostředí považováno za kyselé a sloučenina bude existovat převážně ve své protonované formě. Pokud je pH prostředí větší než pKa sloučeniny, je prostředí považováno za základní a sloučenina bude existovat převážně ve své deprotonované formě.
například pKa kyseliny octové je asi 5. Při pH 1 je prostředí považováno za kyselé a kyselina octová existuje převážně ve své protonované formě., Při pH 8 je životní prostředí považováno za základní a kyselina octová se deprotonuje za vzniku acetátu (CH3CO2-). Naopak pKa fenolu je 10. Při pH 8 je prostředí považováno za kyselé pro fenol a zůstává primárně protonované.
je také důležité si uvědomit, že organická chemie se nemusí vyskytovat ve vodě, takže hodnoty pKa mohou být až 50.
cvičení
1. Vyplňte následující tabulku a uveďte, zda každá sloučenina existuje převážně ve formě protonovaného (kyselého prostředí) nebo deprotonovaného (základního prostředí).,
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.,d597″>












Leave a Reply