Lernziele
- Definieren Arrhenius Säure.
- Geben Sie Beispiele für Arrhenius-Säuren.
- Beschreiben Sie das Hydroniumion.
- Definieren Arrhenius-Basis.
- Geben Sie Beispiele für Arrhenius-Basen.
Arrhenius Säuren
Atme nicht zu tief ein.
 Venus ist der uns am nächsten gelegene Planet, hat aber eine sehr unterschiedliche und feindliche Umgebung.
Venus ist der uns am nächsten gelegene Planet, hat aber eine sehr unterschiedliche und feindliche Umgebung.
Es hat eine Oberflächentemperatur von durchschnittlich 450°C., Die Atmosphäre besteht aus Kohlendioxid, aber Wolken von Schwefelsäure bewegen sich durch die obere Atmosphäre und tragen dazu bei, die extrem unfreundlichen Bedingungen zu schaffen. Aufgrund dieser Bedingungen ist Venus kein Ort, den Sie im Urlaub besuchen möchten.
Arrhenius-Säuren
Der schwedische Chemiker Svante Arrhenius (1859-1927) schlug als erster eine Theorie vor, die das beobachtete Verhalten von Säuren und Basen erklärte. Aufgrund ihrer Fähigkeit, einen Strom zu leiten, wusste er, dass sowohl Säuren als auch Basen Ionen in Lösung enthielten., Eine Arrhenius-Säure ist eine Verbindung, die ionisiert, um Wasserstoffionen (H + ) in wässriger Lösung zu ergeben.
Säuren sind molekulare Verbindungen mit ionisierbaren Wasserstoffatomen. Nur Wasserstoffatome, die Teil einer hochpolaren kovalenten Bindung sind, sind ionisierbar. Chlorwasserstoff (HCl) ist ein gas bei Raumtemperatur und unter Normaldruck. Die H-Cl-Bindung in Chlorwasserstoff ist eine polare Bindung. Das Wasserstoffatom ist wegen der höheren Elektronegativität des Chloratoms elektronenarm., Folglich wird das Wasserstoffatom von dem einsamen Elektronenpaar in einem Wassermolekül angezogen, wenn HCl in Wasser gelöst wird. Das Ergebnis ist, dass die H-Cl-Bindung bricht, wobei beide Bindungselektronen mit dem Cl verbleiben und ein Chloridion bilden. Das H + – Ion bindet sich an das Wassermolekül und bildet ein polyatomares Ion, das Hydroniumion genannt wird. Das Hydroniumion (H 3 O + ) kann als Wassermolekül mit einem angeschlossenen Wasserstoffion betrachtet werden.

Abbildung 1. Bildung eines Hydroniumions.,
Gleichungen, die die Ionisierung einer Säure in Wasser zeigen, werden häufig vereinfacht, indem das Wassermolekül weggelassen wird:
![]()
Dies ist lediglich eine Vereinfachung der vorherigen Gleichung, wird jedoch häufig verwendet. Alle Wasserstoffionen in einer wässrigen Lösung werden als Hydroniumionen an Wassermoleküle gebunden.
 Nicht alle Wasserstoffatome in molekularen Verbindungen sind ionisierbar. In Methan (CH 4) sind die Wasserstoffatome kovalent an Kohlenstoff in Bindungen gebunden, die nur geringfügig polar sind., Die Wasserstoffatome sind nicht ionisierbar und Methan hat keine sauren Eigenschaften. Essigsäure (CH 3 COOH) gehört zu einer Klasse von Säuren, die organische Säuren genannt werden. Es gibt vier Wasserstoffatome im Molekül, aber nur der eine Wasserstoff, der an ein Sauerstoffatom gebunden ist, ist ionisierbar.
Nicht alle Wasserstoffatome in molekularen Verbindungen sind ionisierbar. In Methan (CH 4) sind die Wasserstoffatome kovalent an Kohlenstoff in Bindungen gebunden, die nur geringfügig polar sind., Die Wasserstoffatome sind nicht ionisierbar und Methan hat keine sauren Eigenschaften. Essigsäure (CH 3 COOH) gehört zu einer Klasse von Säuren, die organische Säuren genannt werden. Es gibt vier Wasserstoffatome im Molekül, aber nur der eine Wasserstoff, der an ein Sauerstoffatom gebunden ist, ist ionisierbar.
Die O-H-Bindung kann ionisiert werden, um das H + – Ion und das Acetation zu erhalten. Die anderen Wasserstoffatome in diesem Molekül sind nicht sauer.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., Salzsäure und Essigsäure sind monoprotische Säuren. Eine polyprotische Säure ist eine Säure, die mehrere ionisierbare Hydrogene enthält. Die häufigsten polyprotischen Säuren sind entweder diprotisch (wie H 2 SO 4 ) oder triprotisch (wie H 3 SO 4 ).
Arrhenius Basen
Wofür kann dies verwendet werden?

Natrium Hydroxid ist eine vielseitige Chemikalie. Es kann für so alltägliche Zwecke wie die Reinigung verstopfter Abflüsse verwendet werden. Mehrere kommerzielle Präparate enthalten zu diesem Zweck Natriumhydroxid. Es hat auch eine Reihe von Anwendungen im Bereich der Lebensmittelverarbeitung., Eis wird mit NaOH verdickt. Wenn Oliven in einer Lösung eingeweicht werden, die Natriumhydroxid und andere Chemikalien enthält, werden die Oliven schwarz. Weiche Brezeln werden durch die Anwendung von Natriumhydroxid auf das Essen zäh gemacht. Diese Verbindung wurde häufig bei der Synthese von Kunststoffen, zum Ätzen von Aluminium und zum Entfernen von Farben verwendet und wird beim Enthornen von Rindern verwendet (falls dies erforderlich ist).
Arrhenius-Basen
Eine Arrhenius− Base ist eine Verbindung, die ionisiert, um Hydroxidionen (OH -) in wässriger Lösung zu ergeben., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., Beim Auflösen in Wasser dissoziiert jedes in ein Metallkation und das Hydroxidion.
![]()
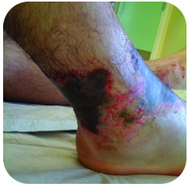
Abbildung 2. Dieser Fuß hat schwere Verbrennungen durch längeren Kontakt mit einer Natriumhydroxidlösung, auch Lauge genannt.
Natriumhydroxid ist eine sehr ätzende Substanz, die auch als Lauge bekannt ist. Lauge wird als strenger Reiniger verwendet und ist ein Bestandteil bei der Herstellung von Seifen. Vorsicht ist bei starken Basen wie Natriumhydroxid geboten, da die Exposition zu schweren Verbrennungen führen kann (siehe Abbildung 2 ).,
Natrium gehört zur Gruppe der Elemente, die als Alkalimetalle bezeichnet werden. Eine alkalische Lösung ist ein anderer Name für eine basische Lösung. Alle Alkalimetalle reagieren leicht mit Wasser, um das Metallhydroxid und Wasserstoffgas zu erzeugen. Die resultierenden Lösungen sind grundlegend.
Basen, die aus einem Alkalimetallkation und dem Hydroxidanion bestehen, sind alle sehr wasserlöslich. Verbindungen der Gruppe 2 Metalle (die Erdalkalimetalle) sind ebenfalls grundlegend. Diese Verbindungen sind jedoch im Allgemeinen nicht so wasserlöslich., Daher werden die Dissoziationsreaktionen für diese Verbindungen als Gleichgewichtsreaktionen gezeigt.
Diese relativ unlöslichen Hydroxide waren einige der im Rahmen der Löslichkeitsproduktkonstante diskutierten Verbindungen ![]() . Die Löslichkeit von Magnesiumhydroxid beträgt 0,0084 g pro Liter Wasser bei 25°C. Aufgrund seiner geringen Löslichkeit ist Magnesiumhydroxid nicht so gefährlich wie Natriumhydroxid., Tatsächlich ist Magnesiumhydroxid der Wirkstoff in einem Produkt namens Magnesiummilch, das als Antazida oder mildes Abführmittel verwendet wird.
. Die Löslichkeit von Magnesiumhydroxid beträgt 0,0084 g pro Liter Wasser bei 25°C. Aufgrund seiner geringen Löslichkeit ist Magnesiumhydroxid nicht so gefährlich wie Natriumhydroxid., Tatsächlich ist Magnesiumhydroxid der Wirkstoff in einem Produkt namens Magnesiummilch, das als Antazida oder mildes Abführmittel verwendet wird.
Zusammenfassung
- Arrhenius-Säure ist definiert.
- Beispiele für Arrhenius-Säuren sind angegeben.
- Die Arrhenius-Basis ist definiert.
- Beispiele für Arrhenius-Basen sind gegeben.
Praxis
Lesen Sie das Material unter dem folgenden Link und beantworten Sie die folgenden Fragen:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- Was war die erste wissenschaftliche Idee von Arrhenius?
- Was hat sein Doktoratskomitee darüber gedacht?,
- Was hat er für diese Idee gewinnen?
- Schreiben Sie die generische Gleichung für die Dissoziation einer Arrhenius-Säure.
Leave a Reply