Periodische Trends
Zunächst konzentrieren wir uns auf einzelne Atome und denken über Trends nach, die mit der Position eines Elements im Periodensystem verbunden sind. Wir werden als erste Modelle die einfachen organischen Verbindungen Ethan, Methylamin und Methanol verwenden, aber die Konzepte gelten gleichermaßen für komplexere Biomoleküle wie die Seitenketten von Alanin, Lysin und Serin.,
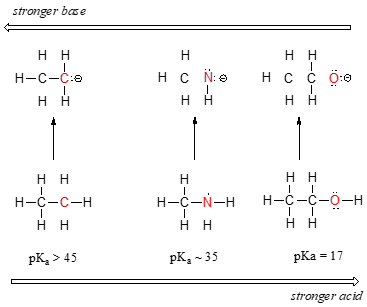
Wir können einen klaren Säuretrend sehen, wenn wir uns entlang der zweiten Zeile des Periodensystems von links nach rechts bewegen von Kohlenstoff zu Stickstoff zu Sauerstoff. Der Schlüssel zum Verständnis dieses Trends besteht darin, die hypothetische konjugierte Base in jedem Fall zu berücksichtigen: Je stabiler (schwächer) die konjugierte Base ist, desto stärker ist die Säure. Schauen Sie sich an, wo die negative Ladung in jeder konjugierten Basis landet., Im Ethylanion wird die negative Ladung von Kohlenstoff getragen, während sich im Methylaminanion und im Methoxidanion die Ladungen auf einem Stickstoff bzw. einem Sauerstoff befinden. Denken Sie an den periodischen Trend der Elektronegativität: Er nimmt auch zu, wenn wir uns entlang einer Reihe von links nach rechts bewegen, was bedeutet, dass Sauerstoff der elektronegativste der drei und Kohlenstoff der geringste ist. Je elektronegativer ein Atom ist, desto besser kann es eine negative Ladung tragen., Somit ist das Methoxidanion das stabilste (niedrigste Energie, am wenigsten basisch) der drei konjugierten Basen, und das Ethylanion ist das am wenigsten stabile (höchste Energie, am grundlegendsten).
Wir können die gleichen Ideen verwenden, um den Unterschied in der Basizität zwischen Wasser und Ammoniak zu erklären.
Wenn wir uns die pKavalues für die entsprechenden Konjugatsäuren ansehen, wissen wir, dass Ammoniak basischer ist als Wasser. Sauerstoff, als das elektronegativere Element, hält enger an seinem einsamen Paar als der Stickstoff., Das Stickstoff-einsame Paar bricht daher eher ab und bildet eine neue Bindung an ein Proton – es ist mit anderen Worten grundlegender. Wiederum bedeutet eine reaktivere (stärkere) Konjugatbasis eine weniger reaktive (schwächere) Konjugatsäure.
Wenn wir uns innerhalb einer bestimmten Spalte des Periodensystems vertikal bewegen, beobachten wir erneut einen klaren periodischen Säuretrend. Dies wird am besten mit den Halogeniden veranschaulicht: Die Basizität nimmt wie die Elektronegativität zu, wenn wir die Säule nach oben bewegen.,

Umgekehrt steigt der Säuregehalt in den Halogensäuren, wenn wir die Spalte nach unten bewegen.
Um diesen Trend zu verstehen, werden wir noch einmal die Stabilität der konjugierten Basen betrachten. Da Fluor das elektronegativste Halogenelement ist, können wir erwarten, dass Fluorid auch das am wenigsten basische Halogenion ist. Aber tatsächlich ist es das am wenigsten stabile und das grundlegendste! Es stellt sich heraus, dass bei vertikaler Bewegung im Periodensystem die Größe des Atoms seine Elektronegativität in Bezug auf die Basizität übertrumpft., Der Atomradius von Jod ist ungefähr doppelt so groß wie der von Fluor, so dass in einem Jodion die negative Ladung auf ein deutlich größeres Volumen verteilt ist:

Dies veranschaulicht ein grundlegendes Konzept in der organischen Chemie, das wichtig genug ist, um rot zu setzen:
Elektrostatische Ladungen, ob positiv oder negativ, negativ, sind stabiler, wenn sie „ausgebreitet“ sind als wenn sie auf ein Atom beschränkt sind.,
Wir werden diese Idee während unseres Studiums der organischen Reaktivität in vielen verschiedenen Kontexten immer wieder zum Ausdruck bringen. Im Moment wird das Konzept nur auf den Einfluss des Atomradius auf die Anionenstabilität angewendet. Da Fluorid die am wenigsten stabile (grundlegendste) der Halogenidkonjugatbasen ist, ist HF die am wenigsten saure der Halogensäuren, nur geringfügig stärker als Essigsäure. HALLO, mit einem pKa von etwa -9, ist eine der stärksten Säuren bekannt.
Wichtiger für das Studium der biologischen organischen Chemie sagt uns dieser Trend, dass Thiole saurer sind als Alkohole., Die pKa der Thiolgruppe an der Cysteinseitenkette beträgt beispielsweise etwa 8,3, während die pKa für die Hydroxl an der Serinseitenkette in der Größenordnung von 17 liegt.
Um es noch einmal zu wiederholen: Die Säurestärke nimmt zu, wenn wir uns entlang einer Zeile des Periodensystems nach rechts bewegen und eine Spalte nach unten bewegen.
Zeichnen Sie die Struktur der konjugierten Basis, die sich bilden würde, wenn die folgende Verbindung mit 1 molarem Äquivalent von Natriumhydroxid reagieren würde:
Lösung
Die Resonanz effekt
Im vorherigen Abschnitt konzentrierten wir uns auf periodische Trends – die Unterschiede in Säure und Basizität zwischen Gruppen, in denen das austauschbare Proton an verschiedene Elemente gebunden war., Jetzt ist es an der Zeit darüber nachzudenken, wie die Struktur verschiedener organischer Gruppen zu ihrer relativen Säure oder Basizität beiträgt, selbst wenn es sich um dasselbe Element handelt, das als Protonenspender/ – akzeptor fungiert. Das erste Modellpaar, das wir in Betracht ziehen werden, ist Ethanol und Essigsäure, aber die Schlussfolgerungen, die wir ziehen, gelten gleichermaßen für alle Alkohol-und Carbonsäuregruppen.
Obwohl sie beide Sauerstoffsäuren sind, sind die pKa-Werte von Ethanol und Essigsäure sehr unterschiedlich. Was macht eine Carbonsäure so viel saurer als ein Alkohol?, Wie zuvor beginnen wir mit der Betrachtung der konjugierten Basen.
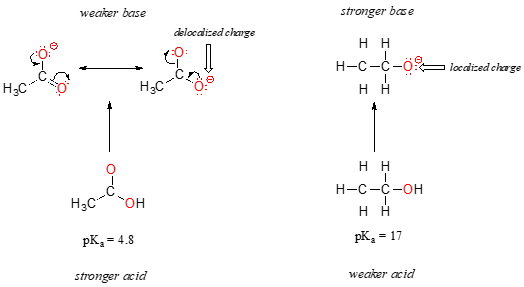
Bei beiden Arten wird die negative Ladung auf der konjugierten Basis von einem Sauerstoff gehalten, sodass keine periodischen Trends aufgerufen werden können. Für Essigsäure gibt es jedoch einen entscheidenden Unterschied: Es kann ein Resonanzfeld gezogen werden, in dem die negative Ladung auf dem zweiten Sauerstoff der Gruppe lokalisiert ist. Die beiden Resonanzformen für die konjugierte Basis sind nach unseren „Resonanzregeln“ energieintensiv gleich., Sie erinnern sich vielleicht daran, dass sich die negative Ladung des Acetations nicht auf dem einen oder anderen Sauerstoff befindet, sondern zwischen den beiden geteilt wird. Chemiker verwenden den Begriff „Delokalisierung der Ladung“, um diese Situation zu beschreiben. Im Ethoxidion hingegen ist die negative Ladung auf den einzelnen Sauerstoff „gesperrt“ – sie hat nirgendwo anders zu gehen.,
Jetzt ist es an der Zeit, an diese Aussage aus dem vorherigen Abschnitt zurückzudenken, die so wichtig war, dass sie in Fettschrift in ihrem eigenen Absatz gedruckt wurde – in der Tat ist es so wichtig, dass wir es einfach noch einmal sagen: „Elektrostatische Ladungen, ob positiv oder negativ, sind stabiler, wenn sie „ausgebreitet“ sind als wenn sie auf ein Atom beschränkt sind.“Jetzt sehen wir dieses Konzept in einem anderen Kontext, in dem eine Ladung durch Resonanz und nicht einfach durch die Größe des beteiligten Atoms „ausgebreitet“ (mit anderen Worten delokalisiert) wird.,
Die Delokalisierung der Ladung durch Resonanz hat eine sehr starke Wirkung auf die Reaktivität organischer Moleküle, genug, um den Unterschied von über 12 pKa-Einheiten zwischen Ethanol und Essigsäure zu erklären (und denken Sie daran, pKa ist ein Log-Ausdruck, daher sprechen wir über einen Unterschied von über 1012 zwischen den Säurekonstanten für die beiden Moleküle). Das Acetat-Ion ist, dass viel stabiler als das Ethoxidion, die alle aufgrund der Auswirkungen der Resonanz delocalization.,
Der Resonanzeffekt erklärt auch gut, warum ein Stickstoffatom basisch ist, wenn es in einem Amin ist, aber nicht basisch, wenn es Teil einer Amidgruppe ist. Es sei daran erinnert, dass in einem Amid aufgrund eines zweiten Resonanzfaktors, in dem das Stickstoff-einsame Paar Teil einer p-Bindung ist, ein signifikanter Doppelbindungscharakter für die Kohlenstoff-Stickstoff-Bindung besteht.
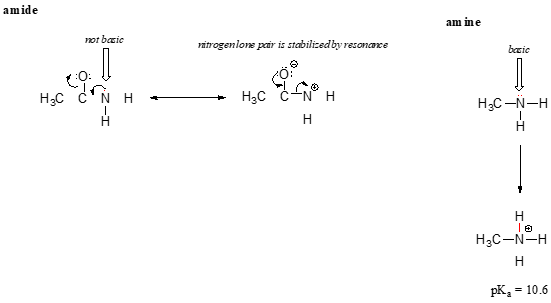
Während das Elektron-Einzelpaar eines Aminstickstoffs an einer Stelle „feststeckt“, wird das Einzelpaar eines Amidstickstoffs durch Resonanz delokalisiert., Beachten Sie, dass wir in diesem Fall unsere zentrale Aussage erweitern, um zu sagen, dass die Elektronendichte – in Form eines einsamen Paares – durch Resonanzdelokalisierung stabilisiert wird, obwohl keine negative Ladung beteiligt ist. Hier ist ein anderer Weg, darüber nachzudenken: Das einsame Paar auf einem Amidstickstoff ist nicht für die Bindung mit einem Proton verfügbar – diese beiden Elektronen sind zu „bequem“, Teil des delokalisierten Pi-Bonding-Systems zu sein. Das einsame Paar auf einem Aminstickstoff ist dagegen nicht Teil eines delokalisierten p-Systems und sehr bereit, eine Bindung mit jedem sauren Proton zu bilden, das sich in der Nähe befinden könnte.,
Oft erfordert es einige sorgfältige Überlegungen, um das saurste Proton auf einem Molekül vorherzusagen. Ascorbinsäure, auch Vitamin C genannt, hat eine pKa von 4,1.
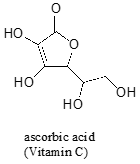
Es gibt vier Hydroxylgruppen auf diesem Molekül – welche ist am saursten? Wenn wir alle vier möglichen konjugierten Basen betrachten, stellen wir fest, dass es nur eine gibt, für die wir die negative Ladung über zwei Sauerstoffatome delokalisieren können.
Ordnen Sie die Verbindungen unten von den meisten sauren zu den am wenigsten sauren und erklären Sie Ihre Argumentation.,c3a3fdb788″>
Lösung
Der induktive Effekt
Vergleichen Sie die pKa-Werte von Essigsäure und ihre Mono -, di-und Tri-chlorierte Derivate:
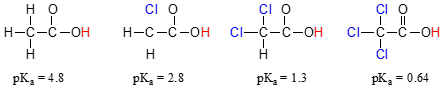
Das Vorhandensein der Chloride erhöht deutlich den Säuregehalt der Carbonsäuregruppe, aber das Argument hier hat nicht mit Resonanz-Delokalisierung zu tun, da für die chlorierten Moleküle keine zusätzlichen Resonanz-Mitwirkenden gezogen werden können., Vielmehr beinhaltet die Erklärung für dieses Phänomen etwas, das induktive Wirkung genannt wird. Ein Chloratom ist elektronegativer als ein Wasserstoff und kann daher die Elektronendichte von der Carboxylatgruppe weg zu sich selbst „induzieren“ oder „ziehen“. Tatsächlich tragen die Chloratome dazu bei, die Elektronendichte der konjugierten Base weiter zu verteilen, was bekanntlich eine stabilisierende Wirkung hat. In diesem Zusammenhang wird der Chlorsubstituent als elektronentziehende Gruppe bezeichnet., Beachten Sie, dass der pKa-senkende Effekt jedes Chloratoms zwar signifikant ist, aber nicht so dramatisch ist wie der delokalisierende Resonanzeffekt, der durch den Unterschied der pKa-Werte zwischen einem Alkohol und einer Carbonsäure veranschaulicht wird. Im Allgemeinen sind Resonanzeffekte stärker als induktive Effekte.
Die induktive elektronenabziehende Wirkung der Chlorine findet durch kovalente Bindungen statt, und ihr Einfluss nimmt mit der Entfernung deutlich ab – somit hat ein Chlor, das zwei Kohlenstoffe von einer Carbonsäuregruppe entfernt ist, eine verminderte Wirkung im Vergleich zu einem Chlor, das nur einen Kohlenstoff entfernt ist.
Leave a Reply