kärnan i en atom är surround av elektroner som upptar skal eller orbitaler av varierande energinivåer.
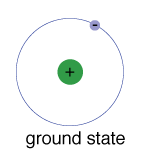
grundtillståndet för en elektron, energinivån det normalt ärupptar, är tillståndet för lägsta energi för den elektronen.
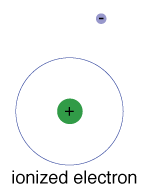
det finns också en maximal energi som varje elektron kanhar och fortfarande är en del av sin atom., Utöver den energin är elektroneninte längre bunden till atomens kärna och den anses vara joniserad.
När en elektron tillfälligt upptar ett energitillstånd som är större ändess marktillstånd är det i ett upphetsat tillstånd. En elektronburkblir upphetsad om den ges extra energi, till exempel om den absorberar en foton eller paket av ljus eller kolliderar med en närliggande atom eller partikel.
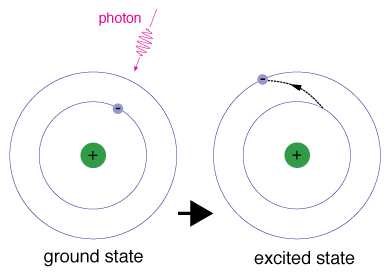
varje orbital har en specifik energi associerad med den., För att anelektron ska förstärkas till en orbital med en högre energi måste denövervinna skillnaden i energi mellan den orbital den är i och denorbital som går. Detta innebär att det måste absorbera en fotonsom innehåller exakt den mängd energi, eller ta exakt denmängd energi från en annan partikel i en kollision.
elektroner stannar inte i upphetsade tillstånd under mycket lång tid-de soonreturnerar till sina marktillstånd och avger en foton med samma energi som den som absorberades.,

övergångar mellan de olika orbitalerna är unika för varje elementeftersom energinivåerna är unikt bestämda av protoner ochneutroner i kärnan. När elektronerna i en viss atom återvändaatt Sänka orbitaler från upphetsade tillstånd, de fotoner som de avger harenergier som är karakteristiska för den typen av atom. Detta ger varjeelement ett unikt fingeravtryck, vilket gör det möjligt att identifieraelement som finns i en behållare med gas, eller till och med en stjärna.
uppdaterad: November 2013
Leave a Reply