de kern van een atoom wordt omgeven door elektronen die schelpen bezetten, of orbitalen met verschillende energieniveaus.
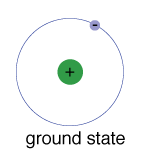
De aardtoestand van een elektron, het energieniveau dat het normaal inneemt, is de toestand van de laagste energie voor dat elektron.
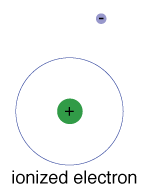
Er is ook een maximale energie die elk elektron kan hebben en nog steeds deel uitmaken van zijn atoom., Naast die energie is het elektron niet langer gebonden aan de kern van het atoom en wordt het geacht te zijn geïoniseerd.
wanneer een elektron tijdelijk een energietoestand heeft die groter is dan zijn aardtoestand, is het in een opgewekte toestand. Een elektron kan worden opgewekt als het extra energie wordt gegeven, zoals wanneer het een foton, of pakket, van licht absorbeert, of botst met een nabijgelegen atoom of deeltje.
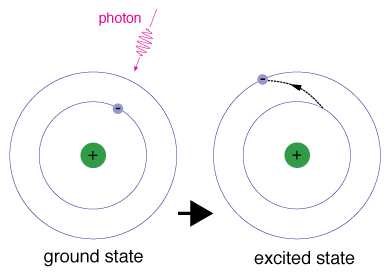
elke orbitaal heeft een specifieke energie., Om een elektron naar een orbitaal met een hogere energie te brengen, moet het het verschil in energie tussen de orbitaal waarin het zich bevindt en het theorbital waarnaar het gaat, bereiken. Dit betekent dat het een foton moet absorberen dat precies die hoeveelheid energie bevat, of precies die hoeveelheid energie uit een ander deeltje moet halen bij een botsing.
elektronen blijven niet lang in aangeslagen toestanden – ze keren terug naar hun grondtoestanden en geven een foton uit met dezelfde energie als het geabsorbeerde foton.,

transities tussen de verschillende orbitalen zijn uniek voor elk element, omdat de energieniveaus uniek worden bepaald door de protonen enneutronen in de kern. Wanneer de elektronen van een bepaald atoom terugkeren naar lagere orbitalen uit opgewekte toestanden, hebben de fotonen die ze uitzenden energie die kenmerkend is voor dat soort atomen. Dit geeft elk element een unieke vingerafdruk, waardoor het mogelijk is om de elementen aanwezig in een container van gas, of zelfs een ster te identificeren.
bijgewerkt: November 2013
Leave a Reply