In der Biochemie ist Ligase, auch Synthetase genannt, ein Enzym, das die Verbindung zweier großer Moleküle durch die Bildung einer neuen chemischen Bindung wie C-O, C-S, C-N katalysiert, oder die Verknüpfung von zwei Verbindungen, normalerweise begleitet von der Hydrolyse einer kleinen angehängten chemischen Gruppe zu einem der größeren Moleküle., Dieses Verfahren assimiliert normalerweise die benötigte Energie aus der Spaltung einer energiereichen Phosphatbindung, beinhaltet die Erhaltung chemischer Energie und bietet eine Verbindung zwischen energiebedürftigen synthetischen Prozessen und energiereichen Abbaureaktionen. In den meisten Fällen fungiert die gleichzeitige Umwandlung von ATP in Adenosin-ADP als Energiequelle., Die ligasekatalysierte Reaktion hat eine allgemeine Formulierung wie folgt:
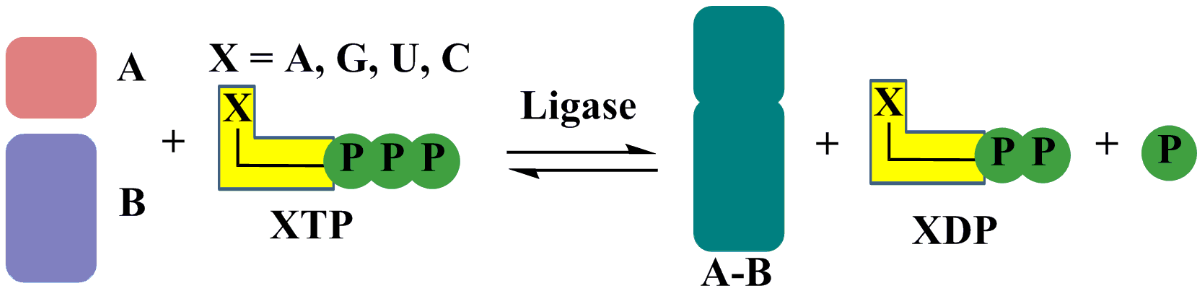
Nomenklatur
Die gebräuchlichen Namen von Ligasen enthalten häufig das Wort „Ligase“, wie DNA-Ligase, ein häufig verwendetes Enzym im Molekularbiolaboratory, um DNA-Fragmente miteinander zu verbinden. Synthetase ist ein weiterer gebräuchlicher Name für Ligasen, da sie bei der Synthese neuer Moleküle angewendet werden. Synthetasen werden manchmal von Synthasen unterschieden und manchmal als Synonym von Synthasen behandelt., Aus der Sicht der Definition werden Nukleosidtriphosphate wie ATP, GTP, CTP, TTP und UTP von Synthetasen verwendet, um Energie zu erzeugen, während Synthasen keine Nukleosidtriphosphate verwenden. Eine Synthase wird auch als Lyase anerkannt, die die Spaltung verschiedener chemischer Bindungen durch Mittel ohne Hydrolyse und Oxidation ohne Energiebedarf katalysiert, während eine Synthetase eine Ligase ist, die zwei Chemikalien oder Verbindungen mit Energiebedarf verbindet., Die Gemeinsame Kommission für biochemische Nomenklatur (JCBN) hat vorgegeben, dass Synthase jedes Enzym darstellen kann, das die Synthese katalysiert, während Synthetase synonym verwendet werden muss.
Klassifikation
Im EG-Nummernklassifikationssystem werden Ligasen als EC 6 klassifiziert und können weiter in sechs Unterklassen eingeteilt werden.
| EC-Nummer | Beschreibung |
| EC-Nummer | Bilden Kohlenstoff-Sauerstoff-Bindungen |
| EC 6.,2 | Form carbon-sulfur bonds |
| EC 6.3 | Form carbon-nitrogen bonds (Argininosuccinate synthetase) |
| EC 6.4 | Form carbon-carbon bonds |
| EC 6.5 | Form phosphoric ester bonds |
| EC 6.,6 | Bilden Stickstoff-Metall-Bindungen, wie in den Chelatasen |
Anwendungen mehrerer gemeinsamer Ligasen
DNA-Ligase ist eine spezifische Art von Enzym, das die Verbindung von DNA-Strängen durch Katalysieren der Bildung einer Phosphodiester-Bindung zwischen Phosphat und Desoxyribose fördert. DNA-Ligase ist während des Replikations -, Reparatur-und Rekombinationsprozesses von DNA aktiv., Es wird häufig bei der Reparatur von Einzelstrang-Brüchen in der Duplex-DNA lebender Organismen unter Verwendung des komplementären Strangs der Doppelhelix als Schablone angewendet, während einige Formen spezifisch Doppelstrang-Schäden beheben können. In molekularbiologischen Laboratorien wird gereinigte DNA-Ligase in großem Umfang beim Klonen von Genen verwendet, um DNA-Moleküle zu rekombinanter DNA zu verbinden. Eine weitere innovative Anwendung der DNA-Ligase ist im Bereich der Nanochemie zu sehen, insbesondere im DNA-Origami., Die DNA-Ligase kann enzymatische Unterstützung bieten, die für den Aufbau einer DNA-Gitterstruktur aus DNA-Überhängen unerlässlich ist, und so nanoskalige Objekte wie Nanomaschinen, nanoelektronische, Biomoleküle und photonische Komponenten weiter zusammenbauen.
Als weiteres typisches Beispiel für Ligase ist die T4-RNA-Ligase 1 in der Lage, die ATP-abhängige kovalente Verbindung von einzelsträngigen 5′-Phosphoryltermini von RNA zu einzelsträngigen 3′-Hydroxyltermini von RNA zu katalysieren., Die T4-RNA-Ligase 2 zeichnet sich durch kritische Signaturreste und eine einzigartige C-terminale Domäne aus, die für die Abdichtung von 3′-OH-und 5′-Phosphoryl-RNA-Enden unerlässlich ist, und katalysiert auch die Verbindung eines 3′ – Hydroxylendes von RNA mit einer 5′ – phosphorylierten RNA. Im Gegensatz zur T4-RNA-Ligase 1 bevorzugt sie doppelsträngige Substrate und ein präadenyliertes Substrat wird bei der Ligatur durch eine abgeschnittene Form der T4-RNA-Ligase 2 benötigt. Die T4-RNA-Ligase ist in der Lage,RNA 3′-end mit Cytidin 3′, 5′-bis-Phosphat zu kennzeichnen, die Zirkularisierung synthetischer Oligonukleotide zu induzieren und standortspezifisch Verbundprimer für PCR zu erzeugen., Spezifische Modifikationen von tRNAs konnten auch mit Hilfe der T4-RNA-Ligase durchgeführt werden, die auch die Ligation von Oligodeoxyribonukleotid zu einzelsträngigen cDNAs für 5′-RENNEN katalysierte.
Ubiquitinligase, auch E3-Ubiquitinligase genannt, ist ein Enzym, das als einzelnes Polypeptid oder multimerer Komplex existiert. E3-Ubiquitinligase könnte zusammen mit dem ubiquitinaktivierenden Enzym E1 und dem ubiquitinkonjugierenden Enzym E2, das mit Ubiquitin beladen wurde, die Ubiquitination verschiedener Proteinsubstrate für den gezielten Abbau durch Proteasom beschleunigen., Das Ubiquitin wird letztendlich an ein Lysin auf dem Substratprotein gebunden, obwohl eine Isopeptidbindung und E3-Ligasen sowohl mit dem Zielprotein als auch mit dem E2-Enzym interagieren könnten, wodurch dem E2-Enzym Substratspezifität verliehen wird. Die Ubiquitination durch E3-Ubiqutinligasen spielt auch eine wesentliche Rolle bei der Regulierung vieler biologischer Prozesse wie Zellhandel, DNA-Reparatur und Signalisierung. Es ist von großer Bedeutung in der Zellbiologie. E3-Ligasen nehmen auch eine Position in der Zellzykluskontrolle und beim Abbau von Cyclinen ein., Das menschliche Genom kodiert mehr als 600 mutmaßliche E3-Ligasen, was zu einer enormen Vielfalt in Substraten führt, während E3s die Spezifität von Proteinsubstraten bestimmen könnten. Jüngste Forschungen haben ergeben, dass viele E3s an menschlichen Krankheiten beteiligt waren und eine Klasse attraktiver „medikamentöser“ Ziele für pharmazeutische Interventionen darstellen.
Ausgewählte Produkte
Ligasen
Leave a Reply