Il nucleo di un atomo è circondato da elettroni che occupano gusci, o orbitali di vari livelli di energia.
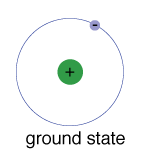
Lo stato fondamentale di un elettrone, il livello di energia che normalmente occupa, è lo stato di energia più bassa per quell’elettrone.
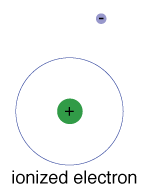
C’è anche un’energia massima che ogni elettrone puòavere ed essere ancora parte del suo atomo., Oltre a questa energia, l’elettron non è più legato al nucleo dell’atomo ed è considerato ionizzato.
Quando un elettrone occupa temporaneamente uno stato energetico maggiore del suo stato fondamentale, si trova in uno stato eccitato. Un elettrone può eccitarsi se gli viene data energia extra, ad esempio se assorbe un fotone o un pacchetto di luce o si scontra con un atomo o una particella nelle vicinanze.
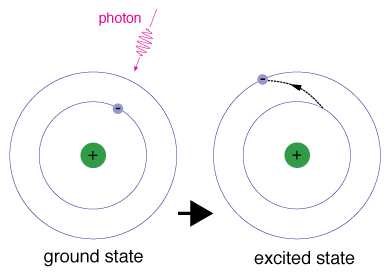
Ogni orbitale ha un’energia specifica ad esso associata., Affinché l’anelettrone possa essere potenziato su un orbitale con un’energia più elevata, deve superare la differenza di energia tra l’orbitale in cui si trova e l’orbitale a cui sta andando. Ciò significa che deve assorbire un fotoche contiene esattamente quella quantità di energia, o prendere esattamente quelloquantità di energia da un’altra particella in una collisione.
Gli elettroni non rimangono in stati eccitati per molto tempo – prestoritornano ai loro stati di base, emettendo un fotone con la stessa energia di quello che è stato assorbito.,

Le transizioni tra i vari orbitali sono uniche per ciascun elementoperché i livelli di energia sono determinati in modo univoco dai protoni e dai neutroni nel nucleo. Quando gli elettroni di un certo atomo ritornano per abbassare gli orbitali dagli stati eccitati, i fotoni che emettono hanno energie che sono caratteristiche di quel tipo di atomo. Ciò conferisce a ciascun elemento un’impronta digitale unica, che consente di identificare gli elementi presenti in un contenitore di gas o anche in una stella.
Aggiornato: novembre 2013
Leave a Reply