In biochimica, ligasi, chiamato anche sintetasi, un enzima che catalizza l’unione di due grandi molecole attraverso la formazione di un nuovo legame chimico come C-O, C-S, C-N, o il collegamento di due composti, di solito accompagnato con l’idrolisi di un piccolo annesso gruppo chimico di una delle molecole più grandi., Questa procedura di solito assimila l’energia necessaria dalla scissione di un legame fosfato ricco di energia, comporta la conservazione dell’energia chimica e offre un collegamento tra processi sintetici che richiedono energia e reazioni di rottura che producono energia. Nella maggior parte dei casi, la conversione simultanea di ATP in adenosina ADP funziona come fonte di energia., La reazione catalizzata dalla ligasi ha una formulazione generale come segue:
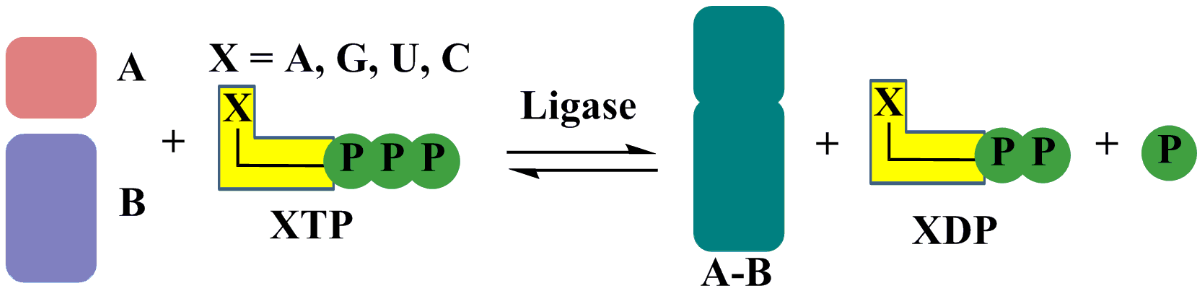
Nomenclatura
I nomi comuni delle ligasi contengono spesso la parola “ligasi”, come la DNA ligasi, un enzima frequentemente usato nel biolaboratorio molecolare per collegare insieme frammenti di DNA. La sintetasi è un altro nome comunemente adottato per le ligasi poiché sono applicate nella sintesi di nuove molecole. Le sintetasi a volte sono distinte dalle sintasi e talvolta trattate come sinonimo di sintasi., Dal punto di vista della definizione, i trifosfati nucleosidici come ATP, GTP, CTP, TTP e UTP sono impiegati dalle sintetasi per produrre energia, mentre le sintasi non utilizzano trifosfati nucleosidici. Una sintasi è anche riconosciuta come una liasi che catalizza la scissione di vari legami chimici attraverso mezzi escludendo l’idrolisi e l’ossidazione senza bisogno di energia, mentre una sintetasi è una ligasi che unisce due sostanze chimiche o composti con fabbisogno energetico., La Joint Commission on Biochemical Nomenclature (JCBN) ha dettato che la sintasi può rappresentare qualsiasi enzima che catalizza la sintesi, mentre la sintetasi deve essere usata come sinonimo.
Classificazione
Nel sistema di classificazione dei numeri CE, le ligasi sono classificate come EC 6 e possono essere ulteriormente classificate in sei sottoclassi.
| numero CE | Descrizione |
| CE 6.1 | Modulo di carbonio e ossigeno obbligazioni |
| CE 6.,2 | Form carbon-sulfur bonds |
| EC 6.3 | Form carbon-nitrogen bonds (Argininosuccinate synthetase) |
| EC 6.4 | Form carbon-carbon bonds |
| EC 6.5 | Form phosphoric ester bonds |
| EC 6.,6 | Formano legami azoto-metallo, come nelle chelatasi |
Applicazioni di diverse ligasi comuni
La DNA ligasi è un tipo specifico di enzima che promuove l’unione di filamenti di DNA catalizzando la formazione di un legame fosfodiestere tra e desossiribosio. La DNA ligasi è attiva durante il processo di replicazione, riparazione e ricombinazione del DNA., Ampiamente si applica nella riparazione delle rotture del singolo-filo nel DNA duplex degli organismi viventi facendo uso del filo complementare della doppia elica come modello, mentre alcune forme possono riparare specificamente i danni del doppio-filo. Nei laboratori di biologia molecolare, la ligasi purificata del DNA è usata estesamente nella clonazione del gene per unire le molecole del DNA insieme per formare il DNA ricombinante. Un’altra applicazione innovativa della DNA ligasi può essere vista nel campo della nanochimica, in particolare negli origami di DNA., DNA ligasi può offrire assistenza enzimatica che è essenziale per costruire la struttura del reticolo del DNA da DNA sopra si blocca, quindi ulteriormente assemblando oggetti su scala nanometrica, come nanomacchine, nanoelettronici, biomolecole, e componente fotonica.
Come un altro tipico esempio di ligasi, la T4 RNA ligasi 1 è in grado di catalizzare l’unione covalente ATP-dipendente di termini 5′-fosforil a singolo filamento di RNA a termini 3′-idrossil a singolo filamento di RNA., T4 RNA ligasi 2 si distingue per i residui di firma critici e un dominio C-terminale unico che è essenziale per la sigillatura di 3′-OH e 5′-phosphoryl RNA ends e catalizza anche l’unione di un 3′-idrossile fine di RNA a un 5′-phosphorylated RNA. A differenza di T4 RNA ligasi 1, preferisce substrati a doppio filamento e un substrato pre-adenilato è richiesto nella legatura da una forma troncata di T4 RNA ligasi 2. T4 RNA ligasi è in grado di etichettare RNA 3′-end con citidina 3′,5′-bis fosfato, indurre la circolarizzazione di oligonucleotidi sintetici, e site-specificly generare primer compositi per PCR., Modifiche specifiche dei TRNA potrebbero anche essere realizzate con l’assistenza della T4 RNA ligasi, che ha anche catalizzato la legatura dell’oligodeossiribonucleotide ai CDNA a filamento singolo per 5′-RACE.
L’ubiquitina ligasi, chiamata anche E3 ubiquitina ligasi, è un enzima esistente come un singolo polipeptide o un complesso multimerico. E3 Ubiquitina ligasi potrebbe lavorare insieme con ubiquitina attivando enzima E1 e ubiquitina coniugando enzima E2 che è stato caricato con ubiquitina, per accelerare l’ubiquitinazione di vari substrati proteici per la degradazione mirata da proteasoma., L’ubiquitina infine è attaccata ad una lisina sulla proteina del substrato sebbene un legame dell’isopeptide e le ligasi E3 possano interagire sia con la proteina dell’obiettivo che con l’enzima E2, così impartendo la specificità del substrato all’enzima E2. L’ubiquitinazione da E3 ubiqutina ligasi svolge anche un ruolo essenziale nella regolazione di molti processi biologici, come il traffico cellulare, la riparazione del DNA e la segnalazione. È di profonda importanza nella biologia cellulare. Le ligasi E3 occupano anche una posizione nel controllo del ciclo cellulare e nella degradazione delle cicline., Il genoma umano codifica più di 600 ligasi E3 putative, con conseguente enorme diversità nei substrati, mentre E3s potrebbe determinare la specificità dei substrati proteici. Recenti ricerche hanno scoperto che molti E3 sono stati implicati nella malattia umana e sono una classe di attraenti obiettivi “drogabili” per l’intervento farmaceutico.
Prodotti in vetrina
Ligases
Leave a Reply