Obiettivi formativi
- Definire l’acido di Arrhenius.
- Fornire esempi di acidi Arrhenius.
- Descrivere lo ion idronio.
- Definire base Arrhenius.
- Fornire esempi di basi di Arrhenius.
Acidi Arrhenius
Non respirare troppo profondamente.
 Venere è il pianeta più vicino a noi, ma ha un ambiente molto diverso e ostile.
Venere è il pianeta più vicino a noi, ma ha un ambiente molto diverso e ostile.
Ha una temperatura superficiale che si aggira intorno ai 450°C., L’atmosfera è composta da anidride carbonica, ma nuvole di acido solforico si muovono attraverso l’atmosfera superiore, contribuendo a creare le condizioni estremamente ostili. A causa di queste condizioni, Venere non è un posto che si desidera visitare in vacanza.
Acidi Arrhenius
Il chimico svedese Svante Arrhenius (1859-1927) fu il primo a proporre una teoria per spiegare il comportamento osservato di acidi e basi. A causa della loro capacità di condurre una corrente, sapeva che sia gli acidi che le basi contenevano ioni in soluzione., Un acido Arrhenius è un composto, che ionizza per produrre ioni idrogeno (H+) in soluzione acquosa.
Gli acidi sono composti molecolari con atomi di idrogeno ionizzabili. Solo gli atomi di idrogeno che fanno parte di un legame covalente altamente polare sono ionizzabili. L’acido cloridrico (HCl) è un gas a temperatura ambiente e sotto pressione normale. Il legame H-Cl nell’acido cloridrico è un legame polare. L’atomo di idrogeno è carente di elettroni a causa della maggiore elettronegatività dell’atomo di cloro., Di conseguenza, l’atomo di idrogeno viene attratto dalla coppia solitaria di elettroni in una molecola d’acqua quando l’HCl viene disciolto in acqua. Il risultato è che il legame H-Cl si rompe, con entrambi gli elettroni di legame che rimangono con il Cl, formando uno chloride cloruro. Lo ion H + si attacca alla molecola d’acqua, formando uno ion poliatomico chiamato hyd idronio. Lo hyd idronio (H 3 O + ) può essere pensato come una molecola d’acqua con uno hydrogen idrogeno attaccato.

Figura 1. Formazione di uno ion idronio.,
Le equazioni che mostrano la ionizzazione di un acido nell’acqua sono spesso semplificate omettendo la molecola d’acqua:
![]()
Questa è solo una semplificazione dell’equazione precedente, ma è comunemente usata. Eventuali ioni idrogeno in una soluzione acquosa saranno attaccati alle molecole d’acqua come ioni idronio.
 Non tutti gli atomi di idrogeno nei composti molecolari sono ionizzabili. Nel metano (CH 4), gli atomi di idrogeno sono legati covalentemente al carbonio in legami che sono solo leggermente polari., Gli atomi di idrogeno non sono in grado di ionizzare e il metano non ha proprietà acide. L’acido acetico (CH 3 COOH) appartiene ad una classe di acidi chiamati acidi organici. Ci sono quattro atomi di idrogeno nella molecola, ma solo l’idrogeno che è legato a un atomo di ossigeno è ionizzabile.
Non tutti gli atomi di idrogeno nei composti molecolari sono ionizzabili. Nel metano (CH 4), gli atomi di idrogeno sono legati covalentemente al carbonio in legami che sono solo leggermente polari., Gli atomi di idrogeno non sono in grado di ionizzare e il metano non ha proprietà acide. L’acido acetico (CH 3 COOH) appartiene ad una classe di acidi chiamati acidi organici. Ci sono quattro atomi di idrogeno nella molecola, ma solo l’idrogeno che è legato a un atomo di ossigeno è ionizzabile.
Il legame O-H può essere ionizzato per produrre lo ion H + e lo acetate acetato. Gli altri atomi di idrogeno in questa molecola non sono acidi.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., L’acido cloridrico e l’acido acetico sono acidi monoprotici. Un acido poliprotico è un acido che contiene più idrogeni ionizzabili. Gli acidi poliprotici più comuni sono diprotici (come H 2 SO 4 ) o triprotici (come H 3 PO 4 ).
Basi di Arrhenius
A cosa può essere usato?

L’idrossido di sodio è una sostanza chimica versatile. Può essere utilizzato per scopi banali come la pulizia degli scarichi intasati. Diversi preparati commerciali contengono idrossido di sodio per questo scopo. Ha anche una serie di applicazioni nel campo della trasformazione alimentare., Il gelato è addensato usando NaOH. Se le olive sono immerse in una soluzione contenente idrossido di sodio e altre sostanze chimiche, le olive diventeranno nere. I salatini morbidi sono resi gommosi dall’applicazione di idrossido di sodio al cibo. Questo composto è stato ampiamente utilizzato nella sintesi di materie plastiche, per l’incisione dell’alluminio, per la rimozione della vernice, ed è impiegato nella decornazione dei bovini (nel caso in cui sia necessario).
Basi di Arrhenius
Una base di Arrhenius è un composto, che ionizza per produrre ioni idrossido (OH− ) in soluzione acquosa., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., Dopo la dissoluzione in acqua, ciascuno si dissocia in un catione metallico e lo hydroxide idrossido.
![]()
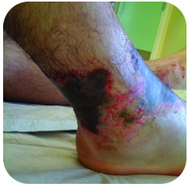
Figura 2. Questo piede ha gravi ustioni a causa del contatto prolungato con una soluzione di idrossido di sodio, noto anche come liscivia.
L’idrossido di sodio è una sostanza molto caustica nota anche come liscivia. Liscivia è usato come un detergente rigoroso ed è un ingrediente nella produzione di saponi. Bisogna fare attenzione con basi forti come l’idrossido di sodio, poiché l’esposizione può portare a gravi ustioni (vedere Figura 2 ).,
Il sodio appartiene al gruppo di elementi chiamati metalli alcalini. Una soluzione alcalina è un altro nome per una soluzione di base. Tutti i metalli alcalini reagiscono prontamente con l’acqua per produrre l’idrossido di metallo e il gas idrogeno. Le soluzioni risultanti sono di base.
Le basi costituite da un catione metallico alcalino e dall’anione idrossido sono tutte molto solubili in acqua. Anche i composti dei metalli del Gruppo 2 (i metalli alcalino-terrosi) sono fondamentali. Tuttavia, questi composti non sono generalmente solubili in acqua., Pertanto le reazioni di dissociazione per questi composti sono mostrate come reazioni di equilibrio.
Questi idrossidi relativamente insolubili erano alcuni dei composti discussi nel contesto della costante di prodotto di solubilità![]() . La solubilità dell’idrossido di magnesio è 0,0084 g per litro d’acqua a 25°C. A causa della sua bassa solubilità, l’idrossido di magnesio non è pericoloso quanto l’idrossido di sodio., Infatti, l’idrossido di magnesio è il principio attivo in un prodotto chiamato latte di magnesia, che viene utilizzato come antiacido o un blando lassativo.
. La solubilità dell’idrossido di magnesio è 0,0084 g per litro d’acqua a 25°C. A causa della sua bassa solubilità, l’idrossido di magnesio non è pericoloso quanto l’idrossido di sodio., Infatti, l’idrossido di magnesio è il principio attivo in un prodotto chiamato latte di magnesia, che viene utilizzato come antiacido o un blando lassativo.
Sommario
- L’acido Arrhenius è definito.
- Vengono forniti esempi di acidi Arrhenius.
- La base di Arrhenius è definita.
- Vengono forniti esempi di basi di Arrhenius.
Pratica
Leggi il materiale al link sottostante e rispondi alle seguenti domande:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- Qual è stata la prima idea scientifica di Arrhenius?
- Cosa ne pensa il suo comitato di dottorato?,
- Cosa ha vinto per questa idea?
- Scrivi l’equazione generica per la dissociazione di un acido Arrhenius.
Recensione
Acidi Arrhenius
- Che cos’è un acido Arrhenius?
- Che cos’è uno ion idronio?
- H2SO4 è un acido monoprotico o un acido poliprotico?
Basi di Arrhenius
- Che cos’è una base di Arrhenius?
- Qual è una reazione che formerà una base di Arrhenius?
- Le basi alcalino-terrose sono molto solubili in acqua?
Leave a Reply