le noyau d’un atome est entouré d’électrons qui occupent des coquilles, ou orbitales de différents niveaux d’énergie.
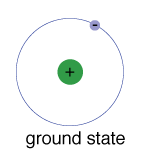
Le terrain de l’état d’un électron, le niveau d’énergie, il normallyoccupies, c’est l’état de plus basse énergie de l’électron.
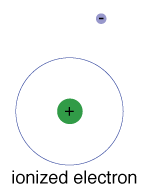
Il y a aussi une énergie maximale que chaque électron peut avoir et faire toujours partie de son atome., Au-delà de cette énergie, l’électronis n’est plus lié au noyau de l’atome et il est considéré comme ionisé.
Lorsqu’un électron occupe temporairement un État d’énergie supérieur àson état fondamental, il est dans un état excité. Un électron peutdevenir excité s’il reçoit une énergie supplémentaire, par exemple s’il absorbe un photon, ou un paquet, de lumière, ou entre en collision avec un atome ou une particule à proximité.
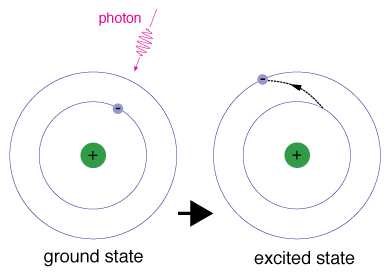
Chaque orbitale a une énergie spécifique associé., Pour que l’anélectron soit boosté à une orbitale avec une énergie plus élevée, il doit dépasser la différence d’énergie entre l’orbitale dans laquelle il se trouve et le theorbital vers lequel il va. Cela signifie qu’il doit absorber un photon qui contient précisément cette quantité d’énergie, ou prendre exactement cette quantité d’énergie d’une autre particule lors d’une collision.
Les électrons ne restent pas très longtemps dans des états excités – ils retournent bientôt à leurs états fondamentaux, émettant un photon avec la même énergie que celui qui a été absorbé.,

Les Transitions entre les différentes orbitales sont uniques pour chaque élément, car les niveaux d’énergie sont déterminés de manière unique par les protons et lesneutrons dans le noyau. Lorsque les électrons d’un certain atome reviennent à des orbitales inférieures d’états excités, les photons qu’ils émettent ont des énergies caractéristiques de ce type d’atome. Cela donne à chaque élément une empreinte digitale unique, permettant d’identifier les éléments présents dans un récipient de gaz, voire une étoile.
mise à Jour: novembre 2013
Leave a Reply