objectifs D’apprentissage
- définir l’acide D’Arrhenius.
- donnez des exemples d’acides D’Arrhenius.
- Décrire l’ion hydronium.
- définir la base D’Arrhenius.
- donnez des exemples de bases D’Arrhenius.
acides D’Arrhenius
ne respirez pas trop profondément.
 Vénus est la planète la plus proche de nous, mais très différentes et hostiles.
Vénus est la planète la plus proche de nous, mais très différentes et hostiles.
sa température de surface est en moyenne d’environ 450°C., L’atmosphère est composée de dioxyde de carbone, mais des nuages d’acide sulfurique se déplacent à travers la haute atmosphère, contribuant à créer des conditions extrêmement hostiles. En raison de ces conditions, Vénus n’est pas un endroit que vous voulez visiter en vacances.
Arrhenius Acides
chimiste suédois Svante Arrhenius (1859-1927) a été le premier à proposer une théorie pour expliquer le comportement observé des acides et des bases. En raison de leur capacité à conduire un courant, il savait que les acides et les bases contenaient des ions en solution., Un acide D’Arrhenius est un composé qui s’ionise pour produire des ions hydrogène (H+) en solution aqueuse.
Les acides sont des composés moléculaires avec des atomes d’hydrogène ionisables. Seuls les atomes d’hydrogène qui font partie d’une liaison covalente hautement polaire sont ionisables. Le chlorure d’hydrogène (HCl) est un gaz à température ambiante et sous pression normale. La Liaison H-Cl dans le chlorure d’hydrogène est une liaison polaire. L’atome d’hydrogène est déficient en électrons en raison de l’électronégativité plus élevée de l’atome de chlore., Par conséquent, l’atome d’hydrogène est attiré par la seule paire d’électrons d’une molécule d’eau lorsque le HCl est dissous dans l’eau. Le résultat est que la Liaison H-Cl se rompt, les deux électrons de liaison restant avec le Cl, formant un ion chlorure. L’ion H + se fixe à la molécule d’eau, formant un ion polyatomique appelé ion hydronium. L’ion hydronium (H 3 O+) peut être considéré comme une molécule d’eau avec un ion hydrogène attaché.

la Figure 1. Formation d’un ion hydronium.,
les Équations montrant l’ionisation d’un acide dans l’eau sont souvent simplifié par l’omission de la molécule d’eau:
![]()
Ce n’est qu’une simplification de l’équation précédente, mais il est couramment utilisé. Tous les ions hydrogène dans une solution aqueuse seront attachés aux molécules d’eau sous forme d’ions hydronium.
 tous les atomes d’hydrogène des composés moléculaires ne sont pas ionisables. Dans le méthane (CH 4), les atomes d’hydrogène sont liés de manière covalente au carbone dans des liaisons qui ne sont que légèrement polaires., Les atomes d’hydrogène ne sont pas capables de s’ioniser et le méthane n’a pas de propriétés acides. L’acide acétique (CH 3 COOH) appartient à une classe d’acides appelés acides organiques. Il y a quatre atomes d’hydrogène dans la molécule, mais seul l’hydrogène lié à un atome d’oxygène est ionisable.
tous les atomes d’hydrogène des composés moléculaires ne sont pas ionisables. Dans le méthane (CH 4), les atomes d’hydrogène sont liés de manière covalente au carbone dans des liaisons qui ne sont que légèrement polaires., Les atomes d’hydrogène ne sont pas capables de s’ioniser et le méthane n’a pas de propriétés acides. L’acide acétique (CH 3 COOH) appartient à une classe d’acides appelés acides organiques. Il y a quatre atomes d’hydrogène dans la molécule, mais seul l’hydrogène lié à un atome d’oxygène est ionisable.
La liaison O-H peut être ionisée pour donner L’ion H + et l’ion acétate. Les autres atomes d’hydrogène de cette molécule ne sont pas acides.,e common acids:
| Acid Name | Formula |
| Hydrochloric acid | HCl |
| Nitric acid | HNO 3 |
| Sulfuric acid | H 2 SO 4 |
| Phosphoric acid | H 3 PO 4 |
| Acetic acid | CH 3 COOH |
| Hypochlorous acid | HClO |
A monoprotic acid is an acid that contains only one ionizable hydrogen., L’acide chlorhydrique et l’acide acétique sont des acides monoprotiques. Un acide polyprotique est un acide qui contient plusieurs hydrogènes ionisables. La plupart des acides polyprotiques courants sont diprotiques (tels que H 2 SO 4 ) ou triprotiques (tels que H 3 PO 4 ).
Bases D’Arrhenius
à quoi cela peut-il servir?

l’hydroxyde de Sodium est un appareil polyvalent de produits chimiques. Il peut être utilisé à des fins banales telles que le nettoyage des drains bouchés. Plusieurs préparations commerciales contiennent de l’hydroxyde de sodium à cet effet. Il a également un certain nombre d’applications dans le domaine de la transformation des aliments., La crème glacée est épaissie à L’aide de NaOH. Si les olives sont trempées dans une solution contenant de l’hydroxyde de sodium et d’autres produits chimiques, les olives deviendront noires. Les bretzels mous sont rendus moelleux par l’application d’hydroxyde de sodium sur les aliments. Ce composé a été très utilisé dans la synthèse des plastiques, pour graver l’aluminium, pour l’enlèvement de peinture, et est employé dans l’écornage des bétail (au cas où c’est un besoin que vous avez).
Bases D’Arrhénius
une base D’Arrhénius est un composé qui s’ionise pour produire des ions hydroxydes (OH− ) en solution aqueuse., The Table below lists several of the more common bases:
| Base Name | Formula |
| Sodium hydroxide | NaOH |
| Potassium hydroxide | KOH |
| Magnesium hydroxide | Mg(OH) 2 |
| Calcium hydroxide | Ca(OH) 2 |
All of the bases listed in the table are solids at room temperature., Lors de la dissolution dans l’eau, chacun se dissocie en un cation métallique et l’ion hydroxyde.
![]()
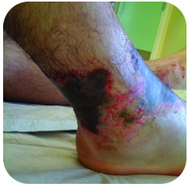
la Figure 2. Ce pied a de graves brûlures dues à un contact prolongé avec une solution d’hydroxyde de sodium, également connue sous le nom de lessive.
l’hydroxyde de Sodium est une substance très caustique également connue sous le nom de lessive. La lessive est utilisée comme nettoyant rigoureux et est un ingrédient dans la fabrication de savons. Des précautions doivent être prises avec des bases fortes comme l’hydroxyde de sodium, car l’exposition peut entraîner de graves brûlures (voir Figure 2 ).,
Le Sodium appartient au groupe des éléments appelés métaux alcalins. Une solution alcaline est un autre nom pour une solution basique. Tous les métaux alcalins réagissent facilement avec l’eau pour produire l’hydroxyde de métal et l’hydrogène gazeux. Les solutions résultantes sont basiques.
Les Bases constituées d’un cation de métal alcalin et de l’anion hydroxyde sont toutes très solubles dans l’eau. Les composés des métaux du Groupe 2 (les métaux alcalino-terreux) sont également basiques. Cependant, ces composés ne sont généralement pas aussi solubles dans l’eau., Par conséquent, les réactions de dissociation de ces composés sont présentées comme des réactions d’équilibre.
Ces relativement insolubles hydroxydes de ont été certains de ces composés discutés dans le contexte de la constante du produit de solubilité ![]() . La solubilité de l’hydroxyde de magnésium est de 0,0084 g par litre d’eau à 25°C. En Raison de sa faible solubilité, l’hydroxyde de magnésium n’est pas aussi dangereux que l’hydroxyde de sodium., En fait, l’hydroxyde de magnésium est l’ingrédient actif d’un produit appelé lait de magnésie, qui est utilisé comme antiacide ou laxatif doux.
. La solubilité de l’hydroxyde de magnésium est de 0,0084 g par litre d’eau à 25°C. En Raison de sa faible solubilité, l’hydroxyde de magnésium n’est pas aussi dangereux que l’hydroxyde de sodium., En fait, l’hydroxyde de magnésium est l’ingrédient actif d’un produit appelé lait de magnésie, qui est utilisé comme antiacide ou laxatif doux.
résumé
- l’acide D’Arrhenius est défini.
- Des exemples d’acides D’Arrhenius sont donnés.
- La base D’Arrhenius est définie.
- Des exemples de bases D’Arrhenius sont donnés.
Pratique
Lire l’article au lien ci-dessous et répondez aux questions suivantes:
http://dwb4.unl.edu/Chem/CHEM869R/CHEM869RLinks/www.nidlink.com/7Ejfromm/arrhenius.htm
- Ce qui était d’Arrhenius » la première idée scientifique?
- qu’en a pensé son Comité de doctorat?,
- Qu’a-t-il gagné pour cette idée?
- écrire l’équation générique pour la dissociation d’un acide D’Arrhenius.
Examen
Arrhenius Acides
- qu’est Ce qu’un Arrhenius de l’acide?
- qu’est Ce qu’un ion hydronium?
- H2SO4 est-il un acide monoprotique ou un acide polyprotique?
Bases D’Arrhenius
- Qu’est-ce qu’une base D’Arrhenius?
- Quelle est une réaction qui formera une base D’Arrhenius?
- Les bases alcalino-terreuses sont – elles très solubles dans l’eau?
Leave a Reply