atomin ytimessä ympäröivät elektronit, jotka vievät kuoret, tai orbitaalit eri energian tasoilla.
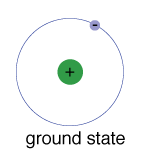
perustilan elektroni, energia tasolla se normallyoccupies, on valtion pienin energia, joka electron.
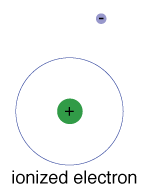
Siellä on myös suurin energiaa, että jokainen elektroni kestävä ja silti olla osa sen atom., Tämän energian lisäksi elektronit eivät enää sitoudu atomin ytimeen, ja sen katsotaan olevan ionisoitunut.
kun elektroni vie tilapäisesti energiatilan, joka on suurempi kuin sen maatila, se on jännittyneessä tilassa. Elektronin canbecome innoissaan, jos se on ylimääräistä energiaa, kuten, jos se absorboi fotonin, tai paketti, valo -, tai törmää lähellä atomi tai hiukkanen.
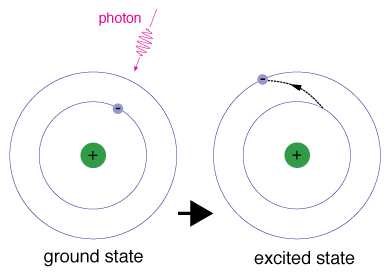
Jokaisella kiertoradalla on tietty energia liittyy siihen., Sillä anelectron olisi lisännyt kiertoradan, jossa on enemmän energiaa, se mustovercome ero energian välillä kiertoradan se on, ja theorbital, johon on menossa. Tämä tarkoittaa, että se on imeä photonthat sisältää juuri sen määrän energiaa, tai ota täsmälleen thatamount energiaa toisen hiukkasen törmäyksessä.
Elektronit eivät pysy innoissaan valtioiden kovin pitkään – ne soonreturn heidän maahan todetaan, säteilee fotonin kanssa samaa energiaa kuin yksi, joka oli imeytynyt.,

Siirtymät eri orbitaalit ovat ainutlaatuisia kullekin elementbecause energia-tasot ovat yksikäsitteisesti määrittää protonien andneutrons tumassa. Kun elektroneja tietyn atomin taas pienempi orbitaalit alkaen innoissaan todetaan, fotonit säteilevät haveenergies, jotka ovat ominaisia sellainen atomi. Tämä antaa eachelement ainutlaatuinen sormenjälki, jolloin on mahdollista tunnistaa theelements läsnä säiliö kaasun, tai jopa tähti.
päivitetty: marraskuuta 2013
Leave a Reply