Suhteellinen Happamuus ja pKa-Arvot
sovellus Henderson-Hasselbach Yhtälö on kyky määrittää suhteellinen happamuus yhdisteitä vertaamalla niiden pKa-arvot. Vahvempi happo, sitä suurempi ionisaatio, pienempi pKa, ja alempi pH-yhdiste tuottaa ratkaisu. Jotkin orgaanisen kemian tutkimuksessa yhdisteille valitut pKa-arvot esitetään täyteläisinä., Koska orgaanisia reaktioita voidaan tehdä muissa kuin vesiympäristöissä, pH voi olla yli 14 ja orgaanisilla yhdisteillä pKa-arvot yli 16. Se on muunnelma Ozin velhosta, ” emme elä enää vedessä.”





Se on erittäin hyvä idea sitoutua muistia arvioitu pKa vaihtelee yhdisteet edellä., Varoituksen sana: kun käytät pKa-taulukkoa, ole ehdottoman varma, että harkitset oikeaa konjugaattihappoa/emäsparia. Jos sinua pyydetään sanoa jotain emäksisyys ammoniakin (NH3) verrattuna ethoxide ion (CH3CH2O-), esimerkiksi asiaa pKa-arvot harkitsemaan ovat 9.2 (pKa ammonium-ioni) ja 16 (pKa etanolia). Näistä luvuista tiedät, että etoksidi on vahvempi emäs. Älä tee virhettä käyttää pKa-arvoa 38: Tämä on ammoniakin pKa, joka toimii happona, ja kertoo, kuinka perus NH2-ioni on (hyvin perus!,)
* sävel veden pKa: veden pKa on 14. Biokemian ja orgaanisen kemian tekstit luettelevat arvon usein 15,7. Näissä teksteissä on virheellisesti otettu huomioon veden konsentraation mooliarvo tasapainovakioon. Tasapainovakion oikeaan derivointiin liittyy veden aktiivisuus, jonka arvo on 1.
Esimerkki
Vaikka tämä kurssi alkaa yhden toiminnallisia ryhmiä, me lopulta työn kanssa mielenkiintoisia yhdisteitä, jotka sisältävät useita toiminnallisia ryhmiä., Tunnustavat, joka vetyä voidaan ionisoitua hapan protonit ja vetyä, joka voi, on hyödyllinen taito. Huomaa tässä esimerkissä, että meidän täytyy arvioida mahdollista happamuutta neljässä eri paikassa molekyylissä.
Aldehydi ja aromaattiset protonit eivät ole ollenkaan happamia (pKavalues ovat yli 40 – ei meidän.taulukko). Hiilessä karbonyylin vieressä olevat kaksi protonia ovat lievästi happamia, pKa-arvot taulukon mukaan noin 19-20., Kaikkein hapan protoni on fenoli-ryhmän, joten jos yhdiste oli tehtävä yksi poskihammas vastaa vahva pohja, tämä on protoni, että olisi lahjoittanut.
Hapan & Perus-Ympäristöissä – Kaikki on Suhteellista Reaktiivisuus
Koska tavoitteenamme on ymmärtää dynaaminen kemiallinen reaktiivisuus, meidän EI tarvitse tietää tietty määrä protonoidut ja unprotonated muotoja yhdiste. Meidän on vain tiedettävä, mikä muoto on vallitseva., Kun pH-ympäristössä on pienempi kuin pKa yhdiste, ympäristö pidetään hapan ja yhdiste on olemassa lähinnä sen protonoidut muodossa. Kun pH ympäristö on suurempi kuin pKa yhdiste, ympäristö pidetään perus-ja yhdiste on olemassa lähinnä sen deprotonated muodossa.
esimerkiksi etikkahapon pKa on noin 5. PH: 1, ympäristö pidetään hapan ja etikkahappo on olemassa lähinnä sen protonoidut muodossa., PH 8: ssa ympäristöä pidetään emäksisenä, ja etikkahappo deprotonoituu muodostaen asetaattia (CH3CO2-). Vastaavasti fenolin pKa on 10. PH 8: ssa ympäristöä pidetään fenolille happamana ja se pysyy pääasiassa protonoituneena.
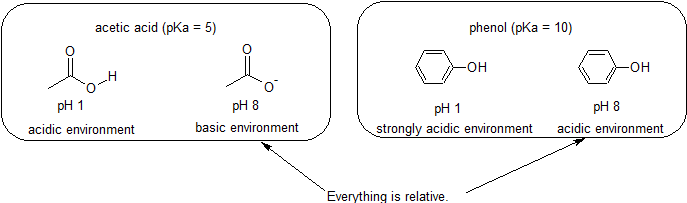
Se on myös tärkeää muistaa, että orgaaninen kemia EI tarvitse esiintyä vettä niin, pKa-arvot voi olla niinkin korkea kuin 50.
Liikunta
1. Täytä alla oleva taulukko osoittaaksesi, onko kutakin yhdistettä pääasiassa sen protonoidussa (happamassa ympäristössä) vai deprotonoidussa (perusympäristössä) muodossa.,
| compound (pKa) | pH 1 environment | pH 8 environment | pH 13 environment |
 |
|||
 |
|||
 |
|||
 |
Answer 1.,d597″>












Leave a Reply